จอตา
ในสัตว์มีกระดูกสันหลัง เรตินา[1] หรือ จอตา[2] หรือ จอประสาทตา[3] (อังกฤษ: retina, พหูพจน์: retinae, จากคำว่า rēte แปลว่า ตาข่าย) เป็นเนื้อเยื่อมีลักษณะเป็นชั้น ๆ ที่ไวแสง บุอยู่บนผิวด้านในของดวงตา การมองเห็นภาพต่าง ๆ นั้นเกิดขึ้นได้โดยอาศัยเซลล์ที่อยู่บนเรตินา เป็นตัวรับและแปลสัญญาณแสงให้กลายเป็นสัญญาณประสาทหรือกระแสประสาท ส่งขึ้นไปแปลผลยังสมองส่วนที่เกี่ยวข้อง ทำให้เราสามารถมองเห็นภาพต่างๆได้ คือ กลไกรับแสงของตาฉายภาพของโลกภายนอกลงบนเรตินา (ผ่านกระจกตาและเลนส์) ซึ่งทำหน้าที่คล้ายกับฟิลม์ในกล้องถ่ายรูป แสงที่ตกลงบนเรตินาก่อให้เกิดปรากฏการณ์ทางเคมีและไฟฟ้าที่เป็นไปตามลำดับ ซึ่งนำไปสู่การส่งสัญญาณประสาทโดยที่สุด ซึ่งดำเนินไปยังศูนย์ประมวลผลทางตาต่าง ๆ ในสมองผ่านเส้นประสาทตา
| เรตินา (Retina) | |
|---|---|
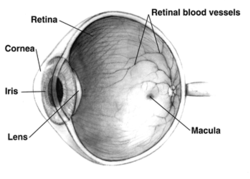 ตามนุษย์ข้างขวาตัดขวาง แต่สัตว์ต่าง ๆ มีตาที่แตกต่างกันอย่างสำคัญ | |
| รายละเอียด | |
| การออกเสียง | UK: /ˈrɛtɪnə/, US: /ˈrɛtənə/, pl. retinae /-ni/ |
| ส่วนหนึ่งของ | ตา |
| ระบบ | ระบบการเห็น |
| หลอดเลือดแดง | Central retinal artery |
| ตัวระบุ | |
| ภาษาละติน | Rēte, tunica interna bulbi |
| MeSH | D012160 |
| TA98 | A15.2.04.002 |
| TA2 | 6776 |
| FMA | 58301 |
| อภิธานศัพท์กายวิภาคศาสตร์ | |
ในสัตว์มีกระดูกสันหลังในช่วงพัฒนาการของเอ็มบริโอ ทั้งเรตินาทั้งเส้นประสาทตามีกำเนิดเป็นส่วนหนึ่งของสมอง ดังนั้น เรตินาจึงได้รับพิจารณาว่าเป็นส่วนของระบบประสาทกลาง (CNS) และจริง ๆ แล้วเป็นเนื้อเยื่อของสมอง[4][5] เป็นส่วนเดียวของระบบประสาทกลางที่สามารถเห็นได้โดยไม่ต้องอาศัยการผ่าการเจาะ
เรตินามีโครงสร้างเป็นชั้น ๆ เป็นชั้นของเซลล์ประสาทที่เชื่อมต่อกันผ่านไซแนปส์ แต่มีเซลล์ที่เรียกว่า "เซลล์รับแสง" (photoreceptor cell) เท่านั้นที่ไวต่อแสงโดยตรง ซึ่งโดยหลัก ๆ มีอยู่สองประเภทคือ เซลล์รูปแท่ง (rod cell) และเซลล์รูปกรวย (cone cell) เซลล์รูปแท่งทำงานในที่มีแสงสลัวและทำให้เกิดการเห็นเป็นรูปขาวดำ ส่วนเซลล์รูปกรวยทำให้เกิดการเห็นในช่วงกลางวันเป็นรูปสี ส่วนเซลล์ที่ไวแสงประเภทที่สามที่มีน้อยมากที่เรียกว่า photosensitive retinal ganglion cell (แปลว่า retinal ganglion cells ไวแสง) มีความสำคัญต่อการตอบสนองของร่างกายแบบรีเฟล็กซ์ต่อแสงสว่างในเวลากลางวัน
สัญญาณประสาทจากเซลล์รูปแท่งและเซลล์รูปกรวยจะมีการผ่านการประมวลผลโดยเซลล์ประสาทอื่น ๆ ในเรตินา ออกมาเป็นผลในรูปแบบของศักยะงานส่งจาก retinal ganglion cell (ตัวย่อ RGC) ผ่านแอกซอนของ RGC ที่รวมตัวกันเป็นเส้นประสาทตา ลักษณะสำคัญ ๆ หลายอย่างของการรับรู้ทางการเห็นมีต้นเหตุมาจากการประมวลผลและการเข้ารหัสข้อมูลแสงที่เกิดในเรตินาา
โครงสร้าง
แก้เรตินาของสัตว์มีกระดูกสันหลังมีชั้นต่าง ๆ กัน 10 ชั้น[6] จากใกล้ไปไกลโดยนับลำดับจากวุ้นตา (vitreous body) คือ ใกล้ที่สุดคือชั้นนอกด้านหน้าของศีรษะไปยังชั้นในด้านหลังของศีรษะ
- Inner limiting membrane – เป็นชั้นที่มีเยื่อฐาน (basement membrane) ที่เกิดจากเซลล์ Muller glia
- Nerve fiber layer - เป็นชั้นแอกซอนของ retinal ganglion cell (โดยมีชั้นบาง ๆ ของส่วนสุดของเซลล์ Muller glia อยู่ในระหว่างชั้นนี้กับชั้นที่แล้ว)
- Ganglion cell layer เป็นชั้นนิวเคลียสของ retinal ganglion cell ซึ่งมีแอกซอนที่รวมตัวกันเป็นเส้นประสาทตาเพื่อส่งข้อมูลไปยังสมอง และมี amacrine cell บ้าง[7] ที่มาอยู่ผิดชั้น[4]
- Inner plexiform layer ซึ่งเป็นชั้นของไซแนปส์ระหว่างแอกซอนของ bipolar cell และเดนไดรต์ของ retinal ganglion cell และ amacrine cell[7][4]
- Inner nuclear layer - เป็นชั้นนิวเคลียสของ amacrine cell[7], bipolar cell, และ horizontal cell[8][4]
- Outer plexiform layer - เป็นชั้นแอกซอนของเซลล์รูปแท่งและเซลล์รูปกรวยซึ่งมีส่วนสุดเป็นรูปกลม (spherule) และรูปขั้ว (pedicle) ตามลำดับ โดยมีไซแนปส์เชื่อมต่อกับเด็นไดรต์ของ bipolar cell[4] ส่วนที่จุดภาพชัด (macula) เป็นชั้นที่เรียกว่า Fiber layer of Henle
- Outer nuclear layer - เป็นชั้นตัวเซลล์ของเซลล์รูปแท่งและเซลล์รูปกรวย
- External limiting membrane - เป็นชั้นที่แยกส่วนในของเซลล์รับแสงจากตัวเซลล์
- Photoreceptor layer – เป็นชั้นส่วนนอก (outer segment) ของเซลล์รูปแท่งและเซลล์รูปกรวย
- Retinal pigment epithelium - เป็นชั้นเดี่ยวของ cuboidal cell[9] (โดยมีส่วนที่ยื่นออกไปที่ไม่แสดงในรูป)
โครงสร้างเหล่านี้สามารถย่อลงเป็น 4 ส่วนโดยหน้าที่ คือ การรับแสง, การส่งสัญญาณไปยัง bipolar cell, การส่งสัญญาณไปยัง RGC ซึ่งก็มีแบบที่ไวแสงด้วย (คือ photosensitive ganglion cell), และการส่งสัญญาณไปยังสมองผ่านเส้นประสาทตา ในช่วงที่มีการต่อกันผ่านไซแนปส์ ก็จะมี horizontal cell[8]และ amacrine cell[7]ที่มีการเชื่อมต่อแบบ lateral (คือเชื่อมต่อกันเองภายในชั้น) อยู่ด้วย
เส้นประสาทตาเป็นวิถีประสาทที่เกิดจากแอกซอนของ RGC ที่มารวม ๆ กันส่งสัญญาณโดยหลักไปที่ lateral geniculate body ซึ่งเป็นศูนย์ถ่ายทอดสัญญาณในส่วนหลังของสมองส่วนหน้า (diencephalon) แต่ก็ยังส่งสัญญาณไปยัง superior colliculus, suprachiasmatic nucleus, และนิวเคลียส ของลำเส้นใยประสาทตาอีกด้วย ในสัตว์อันดับวานร เส้นประสาทตาวิ่งผ่านชั้นต่าง ๆ ของเรตินาออกมาแล้วกลายเป็นส่วน "จานประสาทตา" (optic disc)[10]
ยังมีโครงสร้างส่วนอื่น ๆ ที่งอกมาจากเรตินา ที่ไม่มีหน้าที่เกี่ยวกับการเห็นโดยตรงในสัตว์มีกระดูกสันหลังบางประเภทด้วย เช่น ในสัตว์ปีก มีโครงสร้างซับซ้อนเกี่ยวกับหลอดเลือดที่เรียกว่า pecten oculi ที่งอกออกมาจากเรตินาเข้าไปสู่วุ้นตา (vitreous humour) ซึ่งส่งออกซิเจนและสารอาหารไปยังตา และอาจจะช่วยในการมองเห็นอีกด้วย แม้สัตว์เลื้อยคลานก็มีโครงสร้างที่คล้าย ๆ กันแต่ว่า ไม่ซับซ้อนเท่าของนก[11]
ในมนุษย์ผู้ใหญ่ เรตินากินที่ประมาณ 72% ของรูปกลมที่มีเส้นผ่าศูนย์กลางประมาณ 22 มิลลิเมตร มีเซลล์รูปกรวยประมาณ 7 ล้านตัว และมีเซลล์รูปแท่งประมาณ 75-150 ล้านตัว ส่วนที่เรียกว่าจานประสาทตา (optic disc) เป็นส่วนที่บางครั้งเรียกว่า จุดบอด (blind spot) เพราะว่าเป็นส่วนที่ไม่มีเซลล์รับแสง เป็นส่วนที่ใกล้เข้ามาทางจมูกเป็นจุดที่ใยประสาทตาแล่นออกจากตา ปรากฏเป็นรูปวงรีสีขาวมีพื้นที่ประมาณ 3 ตารางมิลลิเมตร
ถัดไปทางขมับของจานประสาทตามีส่วนที่เรียกว่า จุดเห็นชัด (macula) ซึ่งตรงกลางมีจุดที่เรียกว่ารอยบุ๋มจอตา (fovea) เป็นหลุมที่ทำให้เราสามารถมองเห็นได้ชัดที่สุดตรงกลางลานสายตา แต่มีระดับความไวแสงน้อยกว่าส่วนอื่นเนื่องจากไม่มีเซลล์รูปแท่ง สัตว์อันดับวานรรวมทั้งมนุษย์มีรอยบุ๋มเดียวในตาแต่ละข้าง เทียบกับนกบางชนิดเช่นเหยี่ยวซึ่งมีรอยบุ๋ม 2 แอ่งในตาแต่ละข้าง (bifoviate) และสุนัขและแมวซึ่งไม่มีรอยบุ๋มจอตา แต่มีแถบกลางตาที่เรียกว่า visual streak
ส่วนกลาง (central) ของเรตินาขยายออกไป 6 มิลลิเมตรจากรอยบุ๋มจอตา ส่วนต่อจากนั้นก็จะเป็นส่วนเรตินารอบนอก (peripheral) ขอบของเรตินากำหนดโดยส่วนที่เรียกว่า ora serrata[12] จาก ora serrata ข้างหนึ่งไปสู่อีกข้างหนึ่ง ซึ่งเป็นส่วนที่ไวแสงตามเส้นผ่ากลางแนวนอน มีความยาวประมาณ 32 มิลลิเมตร
เรตินามีความหนาไม่เกิน 0.5 มิลลิเมตร มีชั้นสามชั้นที่มีตัวเซลล์และสองชั้นที่เป็นไซแนปส์ รวมทั้ง ribbon synapse[13] เส้นประสาทตามีแอกซอนที่ RGC ส่งไปยังสมอง และมีเส้นเลือดที่เลี้ยงเรตินา RGC อยู่ด้านในสุดของเรตินาและเซลล์รับแสงอยู่ด้านนอกสุด เพราะเหตุแห่งโครงสร้างที่กลับหัวกลับหางเช่นนี้ แสงต้องเดินทางผ่านหรือหลีกเลี่ยง RGC และผ่านส่วนที่เหลือของเรตินา (รวมทั้งหลอดเลือดฝอย แม้ว่าจะไม่ได้แสดงในรูป) ก่อนที่จะไปถึงเซลล์รับแสง แต่ว่า แสงจะไม่ผ่านทะลุเนื้อเยื่อบุผิว (epithelium) หรือคอรอยด์ (เนื้อเยื่อระหว่างเรตินากับชั้นสเครอลา) ซึ่งล้วนแต่เป็นส่วนที่ทึบ
เซลล์เม็ดเลือดขาวในหลอดเลือดฝอยข้างหน้าของเซลล์รับแสง สามารถเห็นเป็นจุดสว่างที่กำลังเคลื่อนที่ไปได้เมื่อมองที่แสงสีน้ำเงิน นี้เรียกว่า blue field entoptic phenomenon (ปรากฏการณ์ที่เกิดในตาโดยลานสีน้ำเงิน) หรือว่า Scheerer's phenomenon
ระหว่างชั้นของ RGC และเซลล์รับแสง มีชั้นสองชั้นประกอบด้วย neuropil (คือเดนไดรต์ และแอกซอนไม่มีปลอกไมอีลิน) คือเป็นจุดที่เกิดไซแนปส์ ชั้นของ neuropil เหล่านั้นเรียกว่า outer plexiform layer และ inner plexiform layer ในชั้น outer เซลล์รับแสงเชื่อมกับ bipolar cell ซึ่งตั้งอยู่ในแนวตั้ง และกับ horizontal cell[8]ซึ่งตั้งอยู่ในแนวนอน ซึ่งทั้งสองเชื่อมกับ RGC ต่อไปอีกทีหนึ่ง
ส่วนกลางของเรตินามากไปด้วยเซลล์รูปกรวยและส่วนรอบ ๆ มากไปด้วยเซลล์รูปแท่ง โดยรวม ๆ แล้วเรตินามีเซลล์รูปกรวยประมาณ 7 ล้านเซลล์ และเซลล์รูปแท่ง 100 ล้านเซลล์ ตรงกลางของจุดเห็นชัด (macula) เป็นรอยบุ๋มจอตาซึ่งเซลล์รูปกรวยมีขนาดเล็กที่สุดและอยู่รวมกันโดยมีการจัดระเบียบเป็นรูปหกเหลี่ยม ซึ่งเป็นระเบียบที่มีประสิทธิภาพมากที่สุด ทำให้มีเซลล์รวมกันอยู่กันได้อย่างหนาแน่นที่สุด เรตินาส่วนนี้เป็นรอยบุ๋มลงไปเพราะมีการย้ายชั้นอื่น ๆ ออกจากหลุม เอียงขึ้นไปทางขอบรอยบุ๋มเป็นส่วนที่เรียกว่า parafovea (แปลว่า ส่วนที่ติดกับรอยบุ๋มจอตา) ซึ่งเป็นส่วนที่หนาที่สุดของเรตินา macula มีสีเหลือง ๆ ที่เกิดจากรงควัตถุที่ปกคลุมอยู่ จึงเรียกอีกอย่างหนึ่งว่า จุดเหลืองจอตา[2] (macula lutea) บริเวณวงแหวนที่ติดกับรอยบุ๋มจอตามีระดับความหนาแน่นของเซลล์รูปแท่งที่ส่งสัญญาณรวมเข้าไปหา bipolar cell ที่สูงสุดในเรตินา เนื่องจากเซลล์รูปกรวยไม่มีการส่งสัญญาณรวมตัวกันในระดับเท่ากับเซลล์รูปแท่ง จึงสามารถส่งข้อมูลได้ละเอียดที่สุดและสามารถเห็นได้ชัดที่สุดที่รอยบุ๋มจอตา[4]
แม้ว่าเซลล์รับแสงหนึ่ง ๆ จะส่งข้อมูลเพียงส่วนเดียวในภาพรวมทั้งหมด แต่ว่า การส่งสัญญาณจากเซลล์รับแสง จะต้องผ่าน bipolar cell และผ่าน RGC แต่ก็ไม่ใช่เป็นการส่งสัญญาณโดยตรงในอัตราส่วน 1 ต่อ 1 เพราะว่า เรตินามีเซลล์รับแสง 150 ล้านเซลล์ แต่มีใยประสาทตาเพียง 1 ล้านเส้น จึงต้องมีการรวมสัญญาณเข้าด้วยกัน นอกจากนั้นแล้ว การเชื่อมต่อกันและกันในแนวด้านข้าง (คือในชั้นเดียวกัน) ของ horizontal cell[8] แล amacrine cell[7] เปิดโอกาสให้เขตหนึ่ง ๆ ของเรตินาสามารถควบคุมอีกเขตหนึ่งได้ เช่น สิ่งเร้าของเรตินาส่วนหนึ่งสามารถยับยั้งการส่งสัญญาณของเรตินาอีกส่วนหนึ่ง การยับยั้งอย่างนี้มีบทบาทสำคัญในการรวมสัญญาณที่ส่งไปทางเขตสมองในระดับที่สูงยิ่งขึ้นไป แม้ว่า ในสัตว์มีกระดูกสันหลังในระดับต่ำอื่น ๆ (เช่นนกพิราบ) จะมีการปรับการส่งสัญญาณแบบ centrifugal ซึ่งก็คือการที่เซลล์ของอีกชั้นหนึ่งสามารถควบคุมการส่งสัญญาณของเซลล์ของอีกชั้นหนึ่ง หรือว่าเขตระดับสูงยิ่ง ๆ ขึ้นไปในสมองสามารถควบคุมการส่งสัญญาณของเซลล์ในเรตินา แต่ว่า ความเป็นไปเช่นนี้ไม่มีในสัตว์อันดับวานร[4]
พัฒนาการของเรตินา
แก้พัฒนาการของเรตินาเริ่มขึ้นที่การเริ่มสร้างลานตา (eye field) สื่อโดยโปรตีน Shh และ Six3 ตามด้วยพัฒนาการของ optic vesicle (ถุงที่มีในช่วงพัฒนาการ) สื่อโดยโปรตีน Pax6 และ Lhx2[15] บทบาทของ Pax6 ในพัฒนาการของตาได้รับการเปิดเผยโดยวอลเตอร์ เกฮ์ริง และคณะ ผู้แสดงว่า การแสดงออกของยีนเป็น Pax6 ในส่วนที่ไม่ปกติมีผลเป็นการสร้างตาขึ้นที่หนวด ที่ปีก และที่ขา ของแมลงวันทอง[16] หลังจากนั้น optic vesicle ก็จะพัฒนาไปเป็นโครงสร้างอีก 3 อย่างคือ neural retina, retinal pigmented epithelium, และ optic stalk ส่วน neural retina จะมี retinal progenitor cells (ตัวย่อ RPC แปลว่า เซลล์บรรพบุรุษของเรตินา) ซึ่งจะพัฒนาไปเป็นเซลล์อีก 7 ประเภทเริ่มที่ retinal ganglion cell และไปจบที่ Muller glia แม้ว่า เซลล์แต่ละชนิดจะพัฒนามาจาก RPC ไปตามลำดับ แต่ก็มีระยะที่คาบเกี่ยวกันระหว่างเซลล์แต่ละชนิด[15] ตัวช่วยกำหนดประเภทของเซลล์ลูก (daughter cell) ของ RPC มาจาก แฟกเตอร์การถอดรหัส (transcription factor) หลายตระกูลรวมทั้ง Basic helix-loop-helix และ Homeobox[17]
นอกจากมีตัวช่วยในการกำหนดประเภทของเซลล์ลูก ก็ยังมีตัวช่วยอื่น ๆ ที่กำหนดแกนบน-ล่าง (Dorsal-Ventral หรือ D-V) และจมูก-ขมับ (Nasal-Temporal หรือ N-T) แกน D-V ตั้งขึ้นตามลำดับความหนาแน่น (เกรเดียนต์) ของ Vax2 จากล่างไปบน ในขณะที่แกน N-T เกิดจากการแสดงออกของ forkhead transcription factor คือ FOXD1 และ FOXG1 นอกจากนั้นแล้ว ยังมีเกรเดียนต์ประเภทอื่น ๆ ในเรตินาที่ช่วยกำหนดปลายทางแอกซอนของ RGC ที่มีระเบียบเป็นแผนที่ภูมิลักษณ์แบบ retinotopic[15]
เลือดหล่อเลี้ยง
แก้มีการไหลเวียนของเลือดสองวงจรในเรตินา ทั้งสองมาจาก ophthalmic artery วงจร uvea (uveal circulation) มาจากหลอดเลือดแดงที่เข้ามาในลูกตาโดยไม่ผ่านเส้นประสาทตา ซึ่งเลี้ยงผนังลูกตาชั้นกลาง (uvea) และชั้นด้านนอกกับชั้นกลาง ๆ ของเรตินา เปรียบเทียบกับ วงจรเรตินา (retinal circulation) ที่เลี้ยงชั้นใน ๆ ของเรตินา โดยผ่านมาทางเส้นประสาทตา เป็นสาขาของ ophthalmic artery เรียกว่า central artery of the retina[4] หลอดเลือดแดงและหลอดเลือดดำแยกออกเป็นสองสาขาหลายครั้งหลายหน สาขาเหล่านี้โดยมากดำเนินไปในลักษณะขนานแต่ก็มีส่วนที่ตัดข้ามกันบ้าง
ลวดลายของเส้นเลือดในเรตินาเป็นไปตามหลักการทางโครงสร้างของรูปธรรมบางชนิด[18] (คือไม่ใช่เป็นไปโดยสุ่ม) ความแตกต่างกันในระหว่างบุคคลของลวดลายเส้นเลือดในเรตินาสามารถใช้ในการระบุบุคคลโดยชีวมิติ (biometric identification) ได้ ความไหลเวียนโลหิตที่เปลี่ยนไปในเส้นเลือดเล็กในเรตินา อาจพบได้เมื่ออายุมากขึ้น[19] เมื่อกระทบกับมลภาวะของอากาศ[20] หรืออาจเป็นตัวบ่งโรคหัวใจและหลอดเลือดเช่นความดันโลหิตสูงและโรคหลอดเลือดแดงแข็ง[21][22][23] การระบุการแบ่งตัวของเส้นเลือดเป็นสองเส้นในเรตินาเป็นขั้นหนึ่งในการทำการวิเคราะห์เช่นนี้[24] ผลการวิเคราะห์การไหลเวียนโลหิตในเส้นเลือดเล็กสามารถใช้เปรียบเทียบกับข้อมูลเกี่ยวกับการแยกตัวเป็นสองง่ามของเส้นเลือดในภาพก้นตา (retinal fundus) จากชุดข้อมูล DRIVE เก็บถาวร 2020-08-06 ที่ เวย์แบ็กแมชชีน
การกำหนดขนาดของหลอดเลือดแดงเล็กและหลอดเลือดดำเล็กใกล้จานประสาทตาเป็นอีกเทคนิคที่ใช้ในการระบุความเสี่ยงต่อโรคหัวใจและหลอดเลือด[25]
ในสัตว์ปีก
แก้เรตินาของสัตว์ปีกไม่มีเส้นเลือด อาจจะเพื่อให้แสงดำเนินไปถึงเซลล์รับแสงโดยปราศจากความขัดข้องและมีผลทำให้เกิดการเห็นที่ชัดขึ้น ดังนั้น เรตินาในสัตว์ปีกจะต้องรับสารอาหารและออกซิเจนจากอวัยวะพิเศษชนิดหนึ่งที่เรียกว่า pecten ซึ่งอยู่ที่จุดบอด (ที่จานประสาทตา) อวัยวะนี้สมบูรณ์ไปด้วยเส้นเลือด เชื่อกันว่า pecten ส่งสารอาหารและออกซิเจนไปยังเรตินาโดยการแพร่ผ่านวุ้นตา (vitreous body) pecten สมบูรณ์ไปด้วยการทำงานของเอนไซม์ alkaline phosphatase และ polarized cell ซึ่งอยู่ในตาข้างดั้งจมูก เป็นความสมควรกับหน้าที่ในการหลั่งสารของ pecten[26]
เซลล์ใน pecten เต็มไปด้วยเม็ดเมลานินมีสีเข้ม ซึ่งมีทฤษฎีว่า มีเพื่อรักษาอวัยวะให้อุ่นโดยดูดซึมแสงที่ตกลงบน pecten มีการพิจารณาว่า กระบวนการนี้เพิ่มระดับเมแทบอลิซึมของ pecten ซึ่งทำให้สามารถส่งโมเลกุลของสารอาหารได้มากขึ้นเพื่อให้เพียงพอต่อความต้องการทางพลังงานของเรตินาในช่วงที่มีการกระทบกับแสงเป็นเวลายาวนาน[27]
หน้าที่
แก้การเห็นภาพหนึ่ง ๆ จะเกิดขึ้นได้ ก็ต้องอาศัยการเร้าเซลล์รูปกรวยและเซลล์รูปแท่งในเรตินาเป็นรูปแบบ และเซลล์ก็จะส่งสัญญาณที่มีการประมวลผลในระบบประสาทต่าง ๆ ต่อ ๆ ไปโดยทำงานพร้อมกันเป็นระบบขนาน เพื่อที่จะจำลองสิ่งแวดล้อมภายนอกเป็นภาพในสมอง
เซลล์รูปกรวยตอบสนองต่อแสงสว่างและสื่อการเห็นรายละเอียดสูงเป็นภาพสีในที่สว่างช่วงกลางวัน (เป็นการเห็นที่เรียกว่า photopic vision) ส่วนเซลล์รูปแท่งอยู่ในระดับอิ่มตัวในช่วงกลางวันและไม่มีบทบาทในการเห็น แต่ว่า จะตอบสนองในที่สลัวและเป็นสื่อแก่การเห็นรายละเอียดที่ต่ำลงมาเป็นภาพสีเดียว (เป็นการเห็นที่เรียกว่า scotopic vision) แสงสว่างในสำนักงานต่าง ๆ โดยมากจะอยู่ในระหว่างสองระดับนั้น (เป็นการเห็นที่เรียกว่า mesopic vision) ซึ่งเป็นระดับความสว่างที่ทั้งเซลล์รูปแท่งและเซลล์รูปกรวยมีบทบาทในข้อมูลการเห็นที่ส่งออกจากตา แต่ข้อมูลที่เซลล์รูปแท่งส่งในการเห็นชนิดนี้ยังไม่ชัดเจน
การตอบสนองของเซลล์รูปกรวยต่อแสงที่มีความยาวคลื่นต่าง ๆ เรียกว่า spectral sensitivity (แปลว่า ความไวสเปกตรัม) ในการเห็นของมนุษย์โดยปกติ มีเซลล์รูปกรวย 3 ประเภทที่มีความไวสเปกตรัมใน 3 ระดับ ซี่งเรียกว่า เซลล์รูปกรวยน้ำเงิน เขียว และแดง แต่อาจจะถูกต้องกว่าถ้าเรียกว่า เซลล์รูปกรวยไวความยาวคลื่นสั้น ไวความยาวคลื่นกลาง และไวความยาวคลื่นยาว
การขาดเซลล์รูปกรวยประเภทต่าง ๆ นั่นแหละเป็นเหตุให้มีความบกพร่องในการเห็นภาพสี ทำให้เกิดตาบอดสีประเภทต่าง ๆ คือ บุคคลเหล่านี้ไม่ใช่ไม่เห็นวัตถุที่มีสีหนึ่ง ๆ แต่ไม่สามารถแยกแยะกลุ่มสีสองกลุ่มที่บุคคลผู้เห็นเป็นปกติสามารถแยกแยะได้ มนุษย์มีเซลล์รูปกรวย 3 ประเภท (คือมี trichromatic vision มีการเห็นใน 3 สเปกตรัม) ในขณะที่สัตว์เลี้ยงลูกด้วยนมโดยมากไม่มีเซลล์รูปกรวยแดง ดังนั้นจึงมีการเห็นภาพสีที่แย่กว่า (เป็น dichromatic vision มีการเห็นใน 2 สเปกตรัม) แต่ว่า ยังมีสัตว์อื่น ๆ อีกที่มีเซลล์รูปกรวย 4 กลุ่ม เช่นมีปลาน้ำจืดประเภทหนึ่ง (trout) ที่มีเซลล์รูปกรวยไวต่อแสงอัลตราไวโอเลต เพิ่มขึ้นจาก 3 ประเภทที่มีในมนุษย์ นอกจากนั้นแล้ว ปลาบางประเภทยังไวต่อแสงโพลาไรส์อีกด้วย
เมื่อแสงตกลงบนเซลล์รับแสง เซลล์ก็จะส่งสัญญาณที่ได้สัดส่วนกับแสงนั้นผ่านไซแนปส์ไปยัง bipolar cell ซึ่งก็ส่งสัญญาณต่อไปยัง RGC นอกจากนั้น สัญญาณจากเซลล์รับแสงยังมีการส่งไปทางด้านข้างระหว่าง horizontal cell[8] และ amacrine cell[7] อีกด้วย ซึ่งแปลงสัญญาณข้อมูลก่อนที่จะไปถึง RGC มีการรวมสัญญาณจากเซลล์รูปแท่งและเซลล์รูปกรวย (โดยเซลล์ในเรตินาที่รับสัญญาณต่อจากเซลล์รับแสง) แม้ว่า เซลล์รูปแท่งจะมีระดับการทำงานมากที่สุดในที่ที่มีแสงสลัว และจะส่งสัญญาณในระดับอิ่มตัวในช่วงกลางวัน ในขณะที่เซลล์รูปกรวยทำงานในที่สว่างกว่าเพราะไม่มีความไวพอที่จะทำงานในที่มีแสงสลัว
แม้ว่า เซลล์ที่กล่าวมาทั้งหมดล้วนแต่เป็นเซลล์ประสาท แต่ว่ามีเพียงแค่ RGC และ amacrine cell จำนวนน้อยเท่านั้นที่สร้างศักยะงาน ในเซลล์รับแสง การกระทบถูกแสงจะเพิ่มความต่างศักย์ (hyperpolarize) ของเยื่อหุ้มเซลล์แบบค่อย ๆ เพิ่มระดับ (graded shift) คือ ส่วนด้านนอกของเซลล์จะมี photopigment และส่วนภายในเซลล์ ระดับของ cyclic guanosine monophosphate (cGMP) ที่ปกติจะรักษาการเปิดประตู Na+ ไว้ ดังนั้น ในภาวะปกติ เซลล์จะมีภาวะลดขั้ว (depolarized) และโฟตอนจากแสงจะเป็นเหตุให้ retinal[28] ซึ่งยึดเหนี่ยวอยู่กับโปรตีนหน่วยรับความรู้สึก (receptor protein) เปลี่ยนรูปแบบไอโซเมอร์ไปเป็น trans-retinal เป็นเหตุเริ่มการทำงานของ G-protein หลายประเภท ซึ่งก็เป็นเหตุให้หน่วยย่อย Ga ของโปรตีนเริ่มการทำงานของเอนไซม์ phosphodiesterase แบบ PDE6 ซึ่งจะทำการรีดิวซ์ cGMP มีผลเป็นการปิดประตู cyclic nucleotide-gated ion channel ระงับการเข้าออกของ Na+ ทำให้เซลล์เปลี่ยนสภาพเป็น hyperpolarized
กระบวนการเช่นนี้ ทำให้ปริมาณของสารสื่อประสาทที่ปล่อยออกลดลงเมื่อมีแสงสว่าง และเพิ่มขึ้นเมื่อระดับแสงลดลง ส่วนตัว photopigment นั้น หมดสีไปในแสงสว่าง ซึ่งจะมีการทดแทนผ่านกระบวนการทางเคมี ดังนั้น ในการเปลี่ยนจากที่สว่างไปในที่มืด อาจจะใช้เวลาถึง 30 นาทีในการที่ตาจะกลับมาถึงระดับไวแสงมากที่สุด
ใน RGC มีการตอบสนองสองแบบ ขึ้นอยู่กับลานรับสัญญาณของเซลล์ RGC มีลานรับสัญญาณโดยคร่าว ๆ เป็นวงกลมในส่วนตรงกลาง ที่แสงสว่างที่มากระทบมีผลต่อการยิงสัญญาณของเซลล์ และมีเขตวงแหวนล้อมรอบ ที่แสงสว่างที่มากระทบมีผลตรงกันข้าม ในเซลล์ ON การเพิ่มความเข้มของแสงตรงกลางลานสัญญาณมีผลทำให้ระดับการยิงสัญญาณเพิ่มขึ้น ในเซลล์ OFF (เซลล์ปิด) การเพิ่มความเข้มของแสงมีผลทำให้ระดับการยิงสัญญาณลดลง ในรูปแบบเชิงเส้น การตอบสนองในลักษณะเช่นนี้เข้ากับขั้นตอนวิธีของ Difference of Gaussians[29] ได้ดี และเป็นพื้นฐานของขั้นตอนวิธีในการตรวจหาขอบ
นอกจากนั้นแล้ว RGC ยังมีความแตกต่างกันในความไวสีและวิธีการรวมข้อมูลทางพื้นที่ (spatial summation) คือ เซลล์ที่มีการรวมข้อมูลทางพื้นที่เป็นเชิงเส้นเรียกว่า X cell (หรือว่า parvocellular cell, P cell, หรือ midget ganglion cell) และที่มีการรวมข้อมูลไม่เป็นเชิงเส้นเรียกว่า Y cell (หรือ magnocellular cell, M cell, หรือ parasol retinal ganglion cell) แต่ว่า ความคล้ายคลึงกันระหว่าง X cell และ Y cell ที่มีในเรตินาของแมว กับ P cell และ M cell ที่มีในเรตินาของสัตว์อันดับวานร อาจจะไม่ตรงไปตรงมาอย่างที่เคยคิด
ในการส่งสัญญาณข้อมูลทางตาต่อไปยังสมอง มีการแบ่งเรตินาออกเป็นสองด้าน คือกึ่งใกล้ขมับ และกึ่งใกล้จมูก แอกซอนจากกึ่งด้านจมูกข้ามไปอีกข้างหนึ่งของสมองที่ส่วนไขว้ประสาทตา (optic chiasma) เข้าไปรวมกับแอกซอนจากกึ่งด้านขมับของตาอีกข้างหนึ่ง ก่อนที่จะดำเนินเข้าไปสู่ lateral geniculate body
แม้ว่าเรตินาจะมีเซลล์รับแสงกว่า 130 ล้านเซลล์ แต่ว่า มีใยประสาท (ซึ่งก็คือแอกซอน) เพียงแค่ 1.2 ล้านเส้นในเส้นประสาทตา นี้แสดงว่า ต้องมีการประมวลผล (pre-processing) ในเรตินา รอยบุ๋มจอตาเป็นส่วนที่มีข้อมูลแม่นยำละเอียดที่สุด แม้ว่าจะกินเนื้อที่เพียงแค่ 0.01% ของลานสายตาทั้งหมด (คือเป็นส่วนเพียงแค่ 2 องศาในลานสายตา) แอกซอนประมาณ 10% ในเส้นประสาทตามีไว้เพื่อข้อมูลจากรอยบุ๋มจอตา
การเข้ารหัสพื้นที่
แก้| เหตุ | ผลในเซลล์ On-centres | ผลในเซลล์ Off-centres |
| แสงตกลงตรงกลางลานรับสัญญาณเท่านั้น | RGC ยิงสัญญาณถี่ | RGC ไม่ยิงสัญญาณ |
| แสงตกลงที่รอบ ๆ ลานรับสัญญาณเท่านั้น | RGC ไม่ยิงสัญญาณ | RGC ยิงสัญญาณถี่ |
| ไม่มีแสงทั้งที่ตรงกลางและรอบ ๆ | RGC ไม่ยิงสัญญาณ | RGC ไม่ยิงสัญญาณ |
| แสงตกลงที่ตรงกลางและรอบ ๆ | RGC ยิงสัญญาณความถี่ต่ำ | RGC ยิงสัญญาณความถี่ต่ำ |
เรตินาไม่ได้ส่งข้อมูลทั้งหมดที่ได้รับไปยังสมองเป็นแบบหนึ่งต่อหนึ่ง คือ เรตินาต้องเข้ารหัสและบีบอัดภาพหนึ่ง ๆ ลงเพื่อให้เหมาะกับสมรรถภาพการรองรับที่จำกัดของเส้นประสาทตา การบีบอัดนั้นจำเป็นเพราะว่ามีเซลล์รับแสงถึง 100 เท่ามากกว่า RGC ดังที่กล่าวแล้ว เรตินาทำอย่างนี้โดยใช้กระบวนการ decorrelation ต่อข้อมูลภาพดังที่จะกล่าวต่อไป โดยใช้โครงสร้างสัญญาณเป็นจุดกลางและส่วนรอบ ๆ มีการประมวลผลโดย bipolar cell และ RGC
RGC มีโครงสร้างลานรับสัญญาณแบบจุดกลางและส่วนรอบ (centre surround) โดยแบ่งออกเป็นเซลล์ on-centre และ off-centre เซลล์ On-centre เพิ่มน้ำหนักให้กับข้อมูลที่ได้ที่ส่วนตรงกลาง และลดน้ำหนักจากข้อมูลที่ได้ส่วนรอบ ๆ ส่วนเซลล์ Off-centre มีพฤติกรรมแนวตรงกันข้าม การ "เพิ่มน้ำหนัก" ก็คือการยิงสัญญาณแบบเร้า (excitatory) และการ "ลดน้ำหนัก" ก็คือการยิงสัญญาณแบบยับยั้ง (inhibitory)
แต่โครงสร้างแบบจุดกลางและส่วนรอบไม่ได้เป็นโครงสร้างที่เห็นได้ทางกายภาพจริง ๆ คือจะไม่สามารถเห็นได้โดยย้อมสีเนื้อเยื่อเพื่อที่จะเห็นความเป็นไปเช่นนั้นในโครงสร้าง เพราะเป็นโครงสร้างเชิงตรรกะ (logical) เป็นนามธรรมเชิงคณิต (mathematically abstract) โดยอาศัยกำลังการเชื่อมต่อกันทางกายภาพของ RGC และ bipolar cell เชื่อกันว่า กำลังการเชื่อมต่อระหว่างเซลล์มีเหตุจากจำนวนและประเภทของประตูไอออน (ion channel) ที่ไซแนปส์ในระหว่าง RGC และ bipolar cell
โครงสร้าง (เชิงตรรกะ) แบบจุดกลางและส่วนรอบเทียบเท่าทางคณิตกับขั้นตอนวิธีการตรวจจับขอบ (edge detection) ที่ใช้โดยนักเขียนโปรแกรมคอมพิวเตอร์เพื่อตรวจหาและเพิ่มความชัดของเส้นขอบในรูปถ่ายดิจิทัล ดังนั้น เรตินาจึงทำการปฏิบัติการต่อภาพเพื่อเพิ่มความชัดของเส้นขอบวัตถุที่อยู่ภายในลานสายตา ยกตัวอย่างเช่น ในรูปของสุนัข แมว และรถยนต์ ส่วนเส้นขอบของวัตถุต่าง ๆ เป็นที่ที่มีข้อมูลมากที่สุด เพื่อที่จะให้สมองในระดับสูง ๆ ขึ้นไป (หรือแม้แต่โปรแกรมในคอมพิวเตอร์) สามารถค้นหาและระบุวัตถุต่าง ๆ เช่นสุนัขและแมว เรตินาเป็นบันไดขั้นแรกในการแยกแยะวัตถุต่าง ๆ ภายในภาพ
เพื่อเป็นตัวอย่าง เมทริกซ์ต่อไปนี้เป็นหัวใจสำคัญในขั้นตอนวิธีคอมพิวเตอร์ในการตรวจจับขอบ เมทริกซ์นี้เทียบเท่ากับโครงสร้างแบบจุดกลางและส่วนรอบ ในตัวอย่างนี้ แต่ละช่องในเมทริกซ์เป็นข้อมูลจากเซลล์รับแสงแต่ละตัว ช่องที่อยู่ตรงกลางเป็นจุดสนใจในที่นี้ ข้อมูลจากเซลล์รับแสงตรงกลางให้คูณด้วย +1 (เพิ่มน้ำหนัก) ส่วนข้อมูลจากเซลล์รับแสงรอบ ๆ ที่ติดกับเซลล์ตรงกลางให้คูณด้วย -1/8 (ลดน้ำหนัก) ผลที่ได้ก็คือการบวกรวมกันของข้อมูลจากช่องทั้ง 9 ช่อง โดยทำซ้ำกันอย่างนี้สำหรับเซลล์รับแสงในทุก ๆ ช่องในภาพโดยกระเถิบไปช่องหนึ่งในแถวไปให้ถึงสุดแถวแล้วจึงกระเถิบไปยังแถวต่อไป
| -1/8 | -1/8 | -1/8 |
| -1/8 | +1 | -1/8 |
| -1/8 | -1/8 | -1/8 |
ค่ารวมของเมทริกซ์คือ 0 ถ้าข้อมูลจาก 9 ช่องเท่ากันทั้งหมด ผลศูนย์แสดงว่าภาพที่ได้รับเสมอกันรอบ ๆ จุดนั้น ถ้าผลมีค่าลบหรือบวก นั่นแสดงว่ามีความแตกต่างกันภายในภาพที่ได้รับรอบ ๆ จุดนั้นที่เป็นลานรับสัญญาณของเซลล์รับแสง 9 เซลล์
เมทริกซ์แสดงกระบวนการที่เกิดขึ้นภายในเรตินาอย่างคร่าว ๆ โดยมีความแตกต่างกันคือ
- ตัวอย่างในเมทริกซ์เป็นตัวอย่างที่ "สมดุล" คือยอดรวมของน้ำหนักเชิงลบเท่ากับยอดรวมของน้ำหนักเชิงบวก ดังนั้นจึงสมดุลกัน แต่ว่า RGC ปกติจะไม่สมดุล
- เมทริกซ์เป็นสี่เหลี่ยม แต่โครงสร้างจุดกลางและส่วนรอบในเรตินาเป็นวงกลม
- นิวรอนรับข้อมูลจากแอกซอนที่ส่งศักยะงานเป็นขบวน คอมพิวเตอร์รับข้อมูลเป็นจำนวนจุดลอยตัวซึ่งมาจากพิกเซลที่รวมตัวกันเป็นภาพ คือข้อมูลจากพิกเซลหนึ่งเท่าเทียมกันกับข้อมูลจากเซลล์รับแสงหนึ่ง
- เรตินาทำการคำนวณเชิงขนานในขณะที่คอมพิวเตอร์ต้องทำการคำนวณทีละพิกเซล เรตินาไม่มีการที่จะต้องทำการคำนวณต่อ ๆ กันหรือต้องกระเถิบไปยังอีกจุดหนึ่งหรืออีกแถวหนึ่งเหมือนกับที่ต้องมีในคอมพิวเตอร์
- horizontal cell[8] และ amacrine cell[7] มีบทบาทสำคัญในการคำนวณ แต่ไม่มีการบ่งถึงโดยตัวอย่างนี้
นี่เป็นตัวอย่างผลลัพธ์ที่เกิดจากภาพที่ผ่านกระบวนการประมวลผลไปแล้ว หลังจากที่ภาพได้รับการเข้ารหัสจากโครงสร้างแบบจุดกลางและส่วนรอบ RGC ก็จะส่งศักยะงานผ่านแอกซอนซึ่งรวมตัวกันเป็นเส้นประสาทตาข้ามส่วนไขว้ประสาทตา (optic chiasm) ไปสุดที่ lateral geniculate nucleus (ตัวย่อ LGN) รายละเอียดหน้าที่ของ LGN ตอนนี้ยังไม่ปรากฏ แต่ LGN ส่งผลลัพธ์ของตนไปยังด้านหลังของสมอง คือ ผลลัพธ์ของ LGN แผ่ไปทางคอร์เทกซ์สายตาปฐมภูมิ (Primary visual cortex หรือเรียกว่า V1)
ลำดับการส่งสัญญาณแบบง่าย ๆ - เซลล์รับแสง → bipolar cell → RGC → ส่วนไขว้ → LGN → V1
ความสำคัญทางคลินิก
แก้มีโรคหลายชนิดทั้งที่เกิดจากกรรมพันธุ์ทั้งที่เกิดภายหลังที่สามารถมีผลต่อเรตินา ยกตัวอย่างเช่น
- Retinitis pigmentosa (จอตาเสื่อมมีสารสี) เป็นกลุ่มโรคทางกรรมพันธุ์ที่มีผลต่อเรตินา ทำให้สูญเสียการเห็นตอนกลางคืนและการเห็นส่วนรอบ ๆ ลานสายตา
- Macular degeneration (การเสื่อมที่จุดภาพชัด) เป็นกลุ่มโรคปรากฏโดยการสูญเสียการเห็นตรงกลางลานสายตาเนื่องจากเกิดการตายหรือความเสียหายต่อเซลล์ใน macula
- Cone-rod dystrophy หมายถึงกลุ่มโรคที่การสูญเสียการเห็นเกิดขึ้นจากความเสื่อมของเซลล์รูปกรวย และ/หรือ เซลล์รูปแท่งในเรตินา
- ในโรคจอตาลอก เรตินาหลุดออกจากด้านหลังของลูกตา หมายถึงการแยกออกจากกันของเรตินาซึ่งเป็นตัวรับความรู้สึกทางประสาทจาก retinal pigment epithelium[30] มีวิธีการรักษาในปัจจุบันหลายอย่างรวมทั้ง pneumatic retinopexy, scleral buckle, cryotherapy, laser photocoagulation (การจับลิ่มโดยใช้แสงเลเซอร์) และ pars plana vitrectomy
- ทั้งโรคความดันโลหิตสูงทั้งโรคเบาหวานอาจมีผลเสียหายต่อเส้นเลือดฝอยที่หล่อเลี้ยงเรตินา มีผลเป็น hypertensive retinopathy (โรคที่จอตาจากความดันโลหิตสูง) และ diabetic retinopathy (โรคที่จอตาจากเบาหวาน)
- Retinoblastoma คือมะเร็งที่จอตา
- สุนัขมีโรคที่เรตินารวมทั้ง retinal dysplasia (เรตินาเจริญผิดปกติ) progressive retinal atrophy (เรตินาฝ่อแบบลุกลาม) และ sudden acquired retinal degeneration (เรตินาเสื่อมเกิดขึ้นแบบทันใด)
- Lipemia retinalis เป็นภาวะที่เรตินาปรากฏเป็นสีขาว ๆ ซึ่งสามารถเกิดจากการสะสมของลิพิด (ไขมัน) เนื่องจากโรค lipoprotein lipase deficiency (ภาวะขาดเอนไซม์ lipase เพื่อย่อยไลโปโปรตีน)
การวินิจฉัยและการรักษา
แก้มีเครื่องมือหลายอย่างเพื่อจะวินิจฉัยโรคที่มีผลต่อเรตินา การส่องตรวจในตา (Ophthalmoscopy) และการถ่ายรูปก้นตา (fundus photography) เป็นวิธีการตรวจดูเรตินา พึ่งเร็ว ๆ นี้ มีการประดิษฐ์ระบบ adaptive optics (กล้องจุลทรรศน์ที่สามารถปรับตัวชดเชยความผิดเพี้ยน) เพื่อส่องดูเซลล์รูปแท่งและเซลล์รูปกรวยในระดับเซลล์ได้ในเรตินาของบุคคลที่ยังเป็นอยู่ และมีบริษัทหนึ่งในประเทศสกอตแลนด์ที่สร้างเทคโนโลยีที่ยังให้แพทย์สามารถตรวจดูเรตินาได้โดยไม่สร้างความไม่สบายให้แก่คนไข้[31] ส่วน Electroretinography (ERG) เป็นวิธีวัดระดับการตอบสนองเชิงไฟฟ้าของเรตินาโดยไม่ต้องทำการผ่าการเจาะ ซึ่งการตอบสนองอาจมีความผิดปกติเนื่องจากโรคบางประเภท (เช่นในโรค Retinitis pigmentosa)
เทคโนโลยีค่อนข้างใหม่อีกอย่างหนึ่งที่กำลังจะเป็นที่แพร่หลายคือ optical coherence tomography (OCT) เทคนิคที่ไม่ต้องเจาะไม่ต้องผ่านี้ สามารถสร้างภาพเชิงปริมาตร 3-มิติ (3D volumetric) หรือภาพรังสีระนาบ (tomogram) แบบตัดขวางมีรายละเอียดสูงของโครงสร้างในเรตินาในระดับรายละเอียดเหมือนกับผ่าพิสูจน์เนื้อเยื่อ
การรักษาบำบัดขึ้นอยู่กับโรค ได้มีการทดลองผ่าตัดเปลี่ยนเรตินาแล้ว แต่ไม่ได้ผลสำเร็จ กำลังมีการพัฒนาเรตินาเทียมที่ MIT, มหาวิทยาลัยเซาเทิร์นแคลิฟอร์เนีย, RWTH Aachen University, และ University of New South Wales ซึ่งจะเป็นการใช้วัตถุปลูกกฝังที่เลี่ยงเซลล์รับแสงของเรตินา โดยทำการกระตุ้นเซลล์ประสาทในเรตินาโดยตรง และใช้สัญญาณที่ส่งมาจากกล้องดิจิทัล
การรักษาเรตินาโดยยีน
แก้การรักษาโดยยีน (Gene therapy) เป็นวิธีการรักษาที่มีอนาคตสดใสในการรักษาโรคเรตินามากมายหลายประเภท ซึ่งเป็นการใช้ไวรัสที่ไม่ทำให้ติดโรคเป็นตัวส่งยีนเข้าไปสู่ส่วนหนึ่งของเรตินา ไวรัสส่งยีน adeno-associated virus (rAAV)[32] มีคุณสมบัติหลายอย่าง ที่ทำให้เป็นไวรัสที่เหมาะสมเพื่อการรักษาโดยใช้ยีน รวมทั้งการไม่ทำให้เกิดโรค การมีปฏิกิริยาจากระบบภูมิคุ้มกันเพียงเล็กน้อย และความสามารถในการตัดต่อยีนในเซลล์ที่ผ่านระยะไมโทซิสได้อย่างสม่ำเสมอและอย่างมีประสิทธิภาพ[33] มีการใช้ไวรัสส่งยีน rAAV เพิ่มขึ้นเรื่อย ๆ ในการตัดต่อยีนใน retinal pigment epithelium, เซลล์รับแสง, และ RGC สามารถเลือกเซลล์เป้าหมายโดยเฉพาะ โดยการเลือก AAV serotype[34], promoter[35], และจุดในลูกตาที่จะฉีดไวรัสเข้าไป
มีการวิจัยเชิงทดลองทางคลินิกหลายงานที่ได้รายงานผลสำเร็จในการใช้ rAAV เพื่อรักษาโรค Leber's Congenital Amaurosis เป็นการแสดงว่าวิธีการบำบัดปลอดภัยและมีประสิทธิผล[36][37] ไม่ปรากฏผลลบข้างเคียงที่สำคัญ และคนไข้ในทั้งสามงานวิจัยมีการปรับปรุงการเห็นที่ดีขึ้นวัดโดยวิธีต่าง ๆ แม้ว่าวิธีที่ใช้วัดจะต่างกันในงานวิจัยทั้งสาม แต่ก็ล้วนแต่ใช้วิธีที่วัดหน้าที่เช่นความชัดเจนของการเห็น (visual acuity)[37][38][39] และการไปในที่ต่าง ๆ ได้ (functional mobility)[38][39][40] และวิธีวัดเชิงวัตถุวิสัยที่ไม่เสี่ยงต่อความลำเอียง เช่นการวัดความสามารถของรูม่านตาในการตอบสนองต่อแสง[36][41] และสภาพที่ดีขึ้นที่เห็นได้โดยใช้การสร้างภาพสมองแบบ fMRI[42] สภาพที่ดีขึ้นเป็นไปในระยะยาว โดยที่คนไข้ยังคงสภาพที่ดีไว้แม้หลังจาก 1.5 ปี[36][37]
รูปแบบโครงสร้างพิเศษของเรตินา และการทำงานของระบบภูมิต้านทาน มีส่วนช่วยในวิธีการรักษานี้[43] Tight junction[44] ที่เป็นส่วนของ blood retinal barrier (แปลว่า เครื่องขวางกั้นเลือดจากเรตินา) แบ่งส่วนด้านในของเรตินาจากเลือด จึงป้องกันเรตินาจากจุลินทรีย์และความเสียหายที่สื่อโดยระบบภูมิคุ้มกัน ซึ่งเพิ่มสมรรถภาพของเรตินาในการตอบสนองการบำบัดรักษาโดยใช้ไวรัสส่งยีน รูปแบบทางกายวิภาคที่มีการแบ่งออกเป็นส่วน ๆ ของตาทำให้ฉีดสารแขวนลอยมีไวรัสที่ใช้ในการรักษาเข้าไปในเนื้อเยื่อเฉพาะได้ง่าย โดยสามารถตรวจดูได้โดยตรงโดยใช้เทคนิคทางจุลศัลยกรรม[45]
ในเรตินาที่มีสิ่งแวดล้อมปกป้องอย่างนี้ ไวรัสส่งยีน AAV สามารถดำรงการแสดงออกของ transgene (ยีนที่ต้องการจะเปลี่ยน) ในระดับสูงที่ retinal pigmented epithelium, เซลล์รับแสง, และ RGC เป็นระยะเวลายาวนานแม้หลังจากการรักษาแค่หนเดียว นอกจากนั้นแล้ว แพทย์ยังสามารถตรวจตาและระบบสายตาได้อย่างง่าย ๆ เป็นประจำเพื่อเฝ้าสังเกตการทำงานของตาและความเปลี่ยนแปลงของเรตินาหลังจากการรักษาด้วยเทคนิคนำสมัยที่ไม่ต้องอาศัยการเจาะการผ่า (noninvasive) เช่น ความชัดเจนของการเห็น (visual acuity), ความไวต่อความเปรียบต่าง (contrast sensitivity), fundus autofluorescence, สมรรถภาพในการเห็นในที่มืด (dark-adapted visual thresholds), ขนาดเส้นเลือด (vascular diameters), การวัดขนาดรูม่านตา (pupillometry), ERG, multifocal ERG, และ OCT[46]
กลวิธีนี้ได้ผลในโรคเรตินาหลายโรคที่มีงานวิจัย รวมทั้งโรคที่เกิดหลอดเหลือดใหม่ซึ่งเป็นลักษณะของ age-related macular degeneration (โรคประสาทตาเสื่อมตามอายุ) diabetic retinopathy (โรคที่จอตาจากเบาหวาน), และ retinopathy of prematurity (โรคที่จอตาในทารกคลอดก่อนกำหนด) เพราะว่า การเกิดหลอดเลือดในเรตินาที่มีการพัฒนาเต็มที่แล้ว ควบคุมได้โดยความสมดุลระหว่าง growth factors เป็นต้นว่า vascular endothelial growth factor กับตัวยับยั้ง (inhibitor) เป็นต้นว่า pigment epithelium-derived factor (PEDF) ของ กระบวนการสร้างเสริมเส้นเลือด (angiogenesis)
การแสดงออกของ PEDF, angiostatin, และโปรตีนของ VEGF receptor ที่ละลายน้ำได้คือ sFlt-1 ซึ่งล้วนแต่เป็นโปรตีนต่อต้านกระบวนการสร้างเสริมเส้นเลือด (antiangiogenic) ล้วนแต่ปรากฏว่าช่วยลดการสร้างเส้นเลือดที่ผิดปกติในสัตว์ทดลอง[47]
เนื่องจากว่า การบำบัดด้วยยีนที่เฉพาะเจาะจงนี้ ไม่สามารถใช้รักษาคนไข้ที่มีโรคจอตาเป็นจำนวนมาก ดังนั้น จึงมีความสนใจเป็นพิเศษเพื่อที่จะพัฒนาการรักษาโดยใช้แฟกเตอร์ทรงชีพ (survival factor) ที่สามารถใช้ในการรักษาที่กว้างขวางกว่า ส่วน Neurotrophic factor มีสมรรถภาพในการควบคุมการเติบโตของนิวรอนในช่วงพัฒนาการ และอาจใช้เพื่อรักษาเซลล์ที่มีอยู่และเพื่อการฟื้นตัวของเซลล์ประสาทที่เกิดความเสียหายในตาได้ neurotrophic factor ที่สามารถเข้ารหัสใน AAV เช่นแฟกเตอร์ในตระกูล fibroblast growth factor และ GDNF สามารถป้องกันเซลล์รับแสงจาก apoptosis (การตายของเซลล์ตามธรรมชาติ) หรือไม่ก็สามารถชลอความตายนั้น[48]
การกราดภาพเรตินา
แก้การกราดภาพเรตินา (retinal scan) อาจใช้เป็นวิธีในการระบุบุคคลโดยชีวภาพ (biometric identification)
ประวัติ
แก้จอร์จ วอลด์, ฮัลดาน เค็ฟเฟอร์ ฮาร์ตลายน์, และแร็กนาร์ แกรนิต ได้รับรางวัลโนเบลสาขาสรีรวิทยาหรือการแพทย์เพราะงานวิจัยวิทยาศาสตร์เกี่ยวกับเรตินา[49]
งานวิจัยเร็ว ๆ นี้ที่มหาวิทยาลัยเพนซิลเวเนียคำนวณอัตราการส่งถ่ายข้อมูลของเรตินามนุษย์ได้ประมาณ 8.75 เมกะบิตต่อวินาที เทียบกับของหนูตะเภาที่ 875 กิโลบิตต่อวินาที[50]
แม็คลาเร็น เพียร์สัน และคณะที่ University College London และโรงพยาบาลจักษุมัวร์ฟิลดส์ในมหานครลอนดอน แสดงในปี ค.ศ. 2006 ว่า สามารถทำการเปลี่ยนเซลล์รับแสงในเรตินาของหนูได้ ถ้าเซลล์ที่รับอยู่ในระยะพัฒนาการวิกฤต (critical developmental stage)[51] เร็ว ๆ นี้แอ็ดเดอร์และคณะในเมืองดับลินแสดงด้วยกล้องจุลทรรศน์อิเล็กตรอนว่า เซลล์รับแสงที่เปลี่ยนให้หนูนั้น เกิดการเชื่อมต่อทางไซแนปส์[52]
ในปี ค.ศ. 2012 เซบาสเชียน ซุง และคณะทำงานที่แล็บในสถาบัน MIT ได้จัดตั้งเกมส์ EyeWire ที่ผู้เล่นสามารถตามรอยนิวรอนในเรตินาได้[53] จุดประสงค์ของโปรเจ็กต์ EyeWire ก็เพื่อจะระบุประเภทของเซลล์โดยเฉพาะ ๆ จากเซลล์เรตินาประเภทต่าง ๆ และเพื่อจะสร้างแผนที่การเชื่อมต่อกันของเซลล์ประสาทในเรตินา ซึ่งจะเป็นตัวช่วยให้เข้าใจการทำงานของระบบการเห็น[54][55]
ในสัตว์อื่น ๆ
แก้ความแตกต่างกันของสัตว์มีกระดูกสันหลังและสัตว์ชั้นเซฟาโลพอด
แก้เรตินาของสัตว์มีกระดูกสันหลังนั้นกลับหัวกลับหาง เพราะว่า เซลล์รับแสงกลับไปอยู่ด้านหลังของเรตินา ดังนั้น แสงต้องเดินผ่านชั้นเซลล์ประสาทอื่น ๆ และเส้นเลือดก่อนที่จะเข้าไปถึงชั้นเซลล์รับแสง โดยนัยตรงข้ามกัน เรตินาของสัตว์ชั้นเซฟาโลพอดมีเซลล์รับแสงอยู่ที่ด้านหน้าของเรตินา โดยมีนิวรอนประมวลผลและเส้นเลือดหลังเซลล์รับแสง เพราะเหตุนี้ สัตว์ชั้นเซฟาโลพอดจึงไม่มีจุดบอด
เรตินาของสัตว์ชั้นเซฟาโลพอดไม่ได้เกิดจากส่วนที่งอกออกจากสมองเหมือนกับในสัตว์มีกระดูกสันหลัง ดังนั้น จึงมีข้อเสนอว่า ความแตกต่างเช่นนี้แสดงว่า ตาของสัตว์มีกระดูกสันหลังและของสัตว์ชั้นเซฟาโลพอดไม่ได้มีกำเนิดเดียวกัน คือเกิดในสายวิวัฒนาการที่ต่างกัน
ในปี ค.ศ. 2009 นักวิจัยโครเกอร์แสดงปลาม้าลายทางกายวิภาคว่า แม้ว่าการจัดระเบียบแบบผกผันจะไม่ใช่การปรับตัวให้เหมาะกับสิ่งแวดล้อม (nonadaptive) เพราะว่า ทำให้เกิดการกระจายแสงซึ่งเป็นสิ่งที่เลี่ยงได้ (และนำไปสู่การสูญเสียแสงที่เป็นข้อมูล ทำให้ภาพไม่ชัด) แต่ว่า การจัดระเบียบแบบนี้ใช้พื้นที่น้อยสำหรับสัตว์ที่มีตาขนาดเล็ก มีวุ้นตาน้อย เพราะว่า ระยะระหว่างตัวเลนส์กับส่วนนอก (outer segment) ที่ไวแสงของเซลล์รับแสง เต็มไปด้วยเซลล์ประสาท[56]
ความแตกต่างกันของเรตินาระหว่างสัตว์มีกระดูกสันหลังและสัตว์ชั้นเซฟาโลพอดเป็นปริศนาอย่างหนึ่งเกี่ยวกับสายวิวัฒนาการซึ่งยังไม่มีคำตอบที่ชัดเจน จากมุมมองทางวิวัฒนาการ โครงสร้างซับซ้อนเช่นเรตินาแบบผกผันอาจเกิดขึ้นได้จากผลของกระบวนการ 2 อย่าง คือ
- เป็นรูปแบบประนีประนอมที่ให้ผลดีที่เกิดจากหน้าที่ต่าง ๆ ซึ่งต้องใช้โครงสร้างที่ขัดแย้งกัน
- เป็นส่วนเหลือจากวิวัฒนาการและการแปรเปลี่ยนของอวัยวะที่เป็นไปอย่างไม่ตรงไปตรงมา มีผลเป็นอวัยวะที่มีการปรับตัวให้เข้ากับสภาพแวดล้อมที่ไม่ดี
แต่ว่า การเห็นเป็นสมรรถภาพสำคัญที่เกิดจากการปรับตัวให้เข้ากับสภาพแวดล้อมในสัตว์มีกระดูกสันหลังชั้นสูง ดังนั้น ถ้าเป็นความจริงว่า เรตินามีโครงสร้างที่ไม่ดี (จากมุมมองของทัศนศาสตร์) อาจจะสมควรที่จะสืบหาความได้เปรียบทางสรีรภาพที่สำคัญยิ่งของเรตินาแบบนี้ ข้อเสนอหนึ่งก็คือว่า การขยายแสงของเซลล์รับแสงในสัตว์เลี้ยงลูกด้วยนม ต้องใช้พลังงานมาก และดังนั้น จึงต้องมีระบบหล่อเลี้ยงที่ใหญ่และสม่ำเสมอ และเป็นความจริงว่า ระบบเครือข่ายเส้นเลือดที่ไม่เหมือนกับในสัตว์อื่น มีสมรรถภาพดีในการหล่อเลี้ยงชั้นเซลล์รับแสงด้วยเลือดเป็นจำนวนมาก ซึ่งแสดงว่า เรตินากลับด้านเป็นการปรับตัวเพื่อให้สามารถส่งออกซิเจนเป็นจำนวนมากไปให้เรตินา สมกับความต้องการทางพลังงานที่สูง และช่วยป้องกันเซลล์ของ retinal pigment epitheliam จากความเสียหายที่เกิดจากแสงและกระบวนการออกซิเดชั่น,[57] ซึ่งแม้ว่า อาจจะดูเหมือนเป็นการทำให้สถานการณ์แย่ลงเพราะเลือดสมบูรณ์ไปด้วยออกซิเจนใน choroid แต่ความจริง มีการกำจัดออกโดยกระบวนการที่ retinal pigment epithelium (RPE) แปรใช้ opsin disc ใหม่[58] และกระบวนการสุดท้ายนี้ทำให้เซลล์รับแสงสามารถมีชีวิตที่ยืนยาวเป็นทศวรรษได้
แม้สัตว์ชั้นเซฟาโลพอดจะมีเรตินาที่ไม่กลับด้าน แต่ก็มีความชัดเจนพอกับตาของสัตว์มีกระดูกสันหลังหลายชนิด ปลาหมึกไม่มีโครงสร้างที่คล้ายกับ RPE ในสัตว์มีกระดูกสันหลัง แม้ว่า เซลล์รับแสงของปลาหมึกจะมีโปรตีน retinochrome ที่แปรใช้ retinal[28] ใหม่เป็นการทำหน้าที่อย่างหนึ่งที่เหมือนกันกับ RPE ในสัตว์มีกระดูกสันหลัง แต่ก็อาจจะกล่าวได้ว่า เซลล์รับแสงของเซฟาโลพอดโดยรวมแล้ว ไม่ได้รับการดูแลรักษาดีเท่ากับของสัตว์มีกระดูกสันหลัง[59]
มีรูปแบบของการจัดรูปแบบเพื่อบำรุงรักษาเรตินาเป็นอย่างที่สาม คือการมีตาเป็นก้านที่สามารถสร้างเพื่อเปลี่ยนใหม่ได้ง่าย (เช่นในล็อบสเตอร์) หรือการมีเรตินาที่เปลี่ยนใหม่ได้ (เช่นในแมงมุมบางประเภท เช่นแมงมุมขว้างใยสกุล Deinopis[60]) แต่เป็นรูปแบบที่มีน้อย
รูปภาพอื่น ๆ
แก้-
โครงสร้างของตา มีป้ายชื่อ
-
โครงสร้างของตาอีกมุมมองหนึ่ง มีป้ายชื่อ
-
แสดงภาพที่มากระทบที่เรตินาโดยที่ไม่มีการแปลผลโดยเส้นประสาทตาหรือคอร์เทกซ์สายตาปฐมภูมิ
ดูเพิ่ม
แก้เชิงอรรถและอ้างอิง
แก้- ↑ "พจนานุกรมคำศัพท์ (หมวด R)". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2016-03-04. สืบค้นเมื่อ 23 ธันวาคม 2556.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|accessdate=(help) - ↑ 2.0 2.1 "ศัพท์บัญญัติอังกฤษ-ไทย, ไทย-อังกฤษ ฉบับราชบัณฑิตยสถาน (คอมพิวเตอร์) รุ่น ๑.๑"
- ↑ "ใครรู้วิธีการรักษาโรค Retinitis pigmentosa (จอประสาทตาเสื่อม) บ้าง ช่วยบอกหน่อย - มีคำตอบ - กูรู". สืบค้นเมื่อ 24 ธันวาคม 2553.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|accessdate=(help)[ลิงก์เสีย] - ↑ 4.0 4.1 4.2 4.3 4.4 4.5 4.6 4.7 "Sensory Reception: Human Vision: Structure and function of the Human Eye" vol. 27, Encyclopaedia Britannica, 1987
- ↑ http://www.uphs.upenn.edu/news/News_Releases/jul06/retinput.htm
- ↑ The Retinal Tunic. Virginia-Maryland Regional College of Veterinary Medicine
- ↑ 7.0 7.1 7.2 7.3 7.4 7.5 7.6 7.7 amacrine cell เป็น interneuron ในเรตินา retinal ganglion cell (ตัวย่อ RGC) รับข้อมูลถึง 70% จาก amacrine cell และ bipolar cell ซึ่งส่งข้อมูล 30% ที่เหลือผ่านการควบคุมโดย amacrine cell
- ↑ 8.0 8.1 8.2 8.3 8.4 8.5 8.6 horizontal cell เป็นนิวรอนที่มีการเชื่อมต่อกันและกันในชั้น Inner nuclear layer ของเรตินาในสัตว์เลี้ยงลูกด้วยนม มีหน้าที่ประสานและควบคุมข้อมูลที่มาจากเซลล์รับแสงหลายตัว ช่วยให้ตาสามารถเห็นได้ทั้งในที่สว่างและที่สลัว
- ↑ cuboidal epithelial cell เป็นเซลล์บุผิวทรงลูกบาศก์ คือส่วนกว้างยาวมีขนาดเท่ากับส่วนสูง สามารถมีแบบเป็นชั้นเดี่ยว ๆ หรือมีหลายชั้นขึ้นอยู่กับตำแหน่งและหน้าที่ในร่างกาย
- ↑ Shepherd, Gordon (2004). The Synaptic Organization of the Brain. New York, NY: Oxford University Press. pp. 217–225. ISBN 978-0-19-515956-1.
- ↑ Romer, Alfred Sherwood; Parsons, Thomas S. (1977). The Vertebrate Body. Philadelphia, PA: Holt-Saunders International. p. 465. ISBN 0-03-910284-X.
- ↑ ora serrata เป็นส่วนเชื่อมต่อที่อยู่ระหว่างเรตินากับ ciliary body มีลักษณะคล้ายฟันเลื่อย
- ↑ ribbon synapse เป็นไซแนปส์ประเภทหนึ่งมีกลไกพิเศษในการปล่อยสารสื่อประสาทโดยใช้ถุงหลายถุงพร้อม ๆ กัน (multivesicular) โดยการวางตำแหน่งประตูแคลเซียม (calcium channel) มีผลให้สามารถปล่อยสารสื่อประสาทได้อย่างรวดเร็ว มีผลเป็นการส่งสัญญาณที่เร็วขึ้น
- ↑ Foundations of Vision เก็บถาวร 2013-12-03 ที่ เวย์แบ็กแมชชีน, Brian A. Wandell
- ↑ 15.0 15.1 15.2 Heavner, W; Pevny, L (Dec 1, 2012). "Eye development and retinogenesis". Cold Spring Harbor perspectives in biology. 4 (12). doi:10.1101/cshperspect.a008391. PMID 23071378.
- ↑ Halder, G; Callaerts, P; Gehring, WJ (Mar 24, 1995). "Induction of ectopic eyes by targeted expression of the eyeless gene in Drosophila". Science. 267 (5205): 1788–92. doi:10.1126/science.7892602. PMID 7892602.
- ↑ Hatakeyama, J; Kageyama, R (Feb 2004). "Retinal cell fate determination and bHLH factors". Seminars in cell & developmental biology. 15 (1): 83–9. doi:10.1016/j.semcdb.2003.09.005. PMID 15036211.
- ↑ Sherman, T: On connecting large vessels to small - the meaning of murray law. Journal of General Physiology vol. 78, pp. 431–453, 1981
- ↑ Adar SD, Klein R, Klein BE, Szpiro AA, Cotch MF, Wong TY, et al. 2010. Air Pollution and the microvasculature: a crosssectional assessment of in vivo retinal images in the population based multiethnic study of atherosclerosis (MESA) . PLoS Med 7: e1000372.
- ↑ Louwies, T; Int Panis, L; Kicinski, M; De Boever, P; Nawrot, Tim S (2013). "Retinal Microvascular Responses to Short-Term Changes in Particulate Air Pollution in Healthy Adults Journal = Environmental Health Perspectives". doi:10.1289/ehp.1205721.
{{cite journal}}: Cite journal ต้องการ|journal=(help) - ↑ Tso, M., Jampol, L.: Path-physiology of hypertensive retinopathy. Ophthalmology vol. 89, 1982
- ↑ Chapman, N., Dell’omo, G., Sartini, M.,Witt, N., Hughes, A., Thom, S., Pedrinelli, R.: Peripheral vascular disease is associated with abnormal arteriolar diameter relationships at bifurcations in the human retina. Clinical Science vol. 103, 2002
- ↑ Patton, N., Aslam, T., MacGillivray, T., Deary, I., Dhillon, B., Eikelboom, R., Yogesan, K., Constable, I.: Retinal image analysis: Concepts, applications and potential. Progress in Retinal and Eye Research vol. 25, pp. 99–127, 2006
- ↑ Azzopardi, G., Petkov, N.: Detection of retinal vascular bifurcations by trainable V4-like filters, in Computer Analysis of Images and Patterns (CAIP), Seville, Lecture Notes in Computer Science, vol. 6854, (Springer-Verlag Berlin Heidelberg, pp.451-459, 2011
- ↑ Wong TY, Knudtson MD, Klein R, Klein BE, Meuer SM, Hubbard LD. 2004. Computer assisted measurement of retinal vessel diameters in the Beaver Dam Eye Study: methodology, correlation between eyes, and effect of refractive errors. Ophthalmology
- ↑ Bawa S.R. and YashRoy R.C. (1972) Effect of dark and light adaptation on the retina and pecten of chicken. Experimental Eye Research , vol. 13, pp. 92-97. https://www.researchgate.net/publication/18108932_Effect_of_dark_and_light_adaptation_on_the_retina_and_pecten_of_chicken?ev=prf_pub
- ↑ Bawa S.R. and YashRoy R.C. (1974) Structure and function of vulture pecten. Acta Anatomica new name, Cells Tissues Organs, vol. 89, pp. 473-480. https://www.researchgate.net/publication/231569868_Structure_and_function_of_vulture_pecten?ev=prf_pub
- ↑ 28.0 28.1 retinal เรียกอีกอย่างหนึ่งว่า retinaldehyde หรือ vitamin A aldehyde เป็นรูปแบบหนึ่งในหลายรูปแบบของวิตามินเอซึ่งในแต่ละสปีชีส์จะมีจำนวนรูปแบบไม่เท่ากัน เป็น polyene chromophore (คือส่วนกำเนิดสีมีพันธะแบบคู่เป็นจำนวนมาก) รวมอยู่ในโปรตีน opsin เป็นโครงสร้างเคมีพื้นฐานในการเห็นของสัตว์
- ↑ Difference of Gaussians เป็นขั้นตอนวิธีเพื่อปรับลักษณะอย่างหนึ่งของภาพให้ชัดขึ้น โดยลบข้อมูลจากรูปที่ชัดกว่าด้วยข้อมูลจากอีกรูปหนึ่งที่ชัดน้อยกว่า
- ↑ Oh, Kean, "Pathogenetic Mechanisms of Retinal Detachment", in Retina, ed. Ryan, S.J., Elsevier Health Sciences, Philadelphia, PA, 2006, p. 2013-2015
- ↑ Seeing into the Future เก็บถาวร 2012-02-12 ที่ เวย์แบ็กแมชชีน Ingenia, March 2007
- ↑ adeno-associated virus (rAAV) เป็นไวรัสขนาดเล็กซึ่งสามารถแพร่พันธุ์ในมนุษย์และสัตว์อันดับวานรอื่น ๆ ได้ เป็นไวรัสที่ไม่ปรากฏว่าก่อโรค และก่อให้เกิดปฏิกิริยาจากระบบภูมิคุ้มกันที่เล็กน้อยมาก
- ↑ Dinculescu Astra, Glushakova Lyudmyla, Seok-Hong Min, Hauswirth William W (2005). "Adeno-associated virus-vectored gene therapy for retinal disease". Human Gene Therapy. 16 (6): 649–663. doi:10.1089/hum.2005.16.649. PMID 15960597.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ serotype หมายถึงความต่าง ๆ กันภายในสปีชีส์ของแบคทีเรียหรือไวรัส หรือของเซลล์ภูมิคุ้มกันในบุคคลต่าง ๆ คือ สิ่งมีชีวิตจุลภาค ไวรัส และเซลล์เหล่านี้ (ที่อยู่ในสปีชีส์เดียวกัน) สามารถจัดประเภทเข้าด้วยกันอาศัยแอนติเจนที่ผิวเซลล์ จึงทำให้สามารถจำแนกประเภทย่อยของสิ่งมีชีวิตในระดับสปีชีส์ย่อย (sub-species)
- ↑ ในพันธุศาสตร์ promoter เป็นเขตใน DNA ที่เริ่มการถอดรหัสของยีนใดยีนหนึ่งโดยเฉพาะ โดยจะอยู่ใกล้ ๆ ยีนที่มันถอดรหัส
- ↑ 36.0 36.1 36.2 Cideciyan A. V., Hauswirth W. W., Aleman T. S., Kaushal S., Schwartz S. B., Boye S. L., Windsor E. A. M.; และคณะ (2009). "Human RPE65 gene therapy for Leber congenital amaurosis: persistence of early visual improvements and safety at 1 year". Human gene therapy. 20 (9): 999–1004. doi:10.1089/hum.2009.086. PMC 2829287. PMID 19583479.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 37.0 37.1 37.2 Simonelli F., Maguire A. M., Testa F., Pierce E. A., Mingozzi F., Bennicelli J. L., Rossi S.; และคณะ (2010). "Gene therapy for Leber's congenital amaurosis is safe and effective through 1.5 years after vector administration". Molecular therapy : the journal of the American Society of Gene Therapy. 18 (3): 643–650. doi:10.1038/mt.2009.277. PMC 2839440. PMID 19953081.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 38.0 38.1 Maguire A. M., Simonelli F., Pierce E. A., Pugh E. N., Mingozzi F., Bennicelli J., Banfi S.; และคณะ (2008). "Safety and efficacy of gene transfer for Leber's congenital amaurosis The". The New England Journal of Medicine. 358 (21): 2240–2248. doi:10.1056/NEJMoa0802315. PMC 2829748. PMID 18441370.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 39.0 39.1 Maguire A. M., High K. A., Auricchio A., Wright J. F., Pierce E. A., Testa F., Mingozzi F.; และคณะ (2009). "Age-dependent effects of RPE65 gene therapy for Leber's congenital amaurosis: a phase 1 dose-escalation trial". Lancet. 374 (9701): 1597–1605. doi:10.1016/S0140-6736(09)61836-5. PMID 19854499.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Bainbridge J. W. B., Smith A. J., Barker S. S., Robbie S., Henderson R., Balaggan K., Viswanathan A.; และคณะ (2008). "Effect of gene therapy on visual function in Leber's congenital amaurosis". The New England Journal of Medicine. 358 (21): 2231–2239. doi:10.1056/NEJMoa0802268. PMID 18441371.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Hauswirth W. W., Aleman T. S., Kaushal S., Cideciyan A. V., Schwartz S. B., Wang L., Conlon T. J.; และคณะ (2008). "Treatment of Leber Congenital Amaurosis Due to RPE65Mutations by Ocular Subretinal Injection of Adeno-Associated Virus Gene Vector: Short-Term Results of a Phase I Trial". Human gene therapy. 19 (10): 979–990. doi:10.1089/hum.2008.107. PMC 2940541. PMID 18774912.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Ashtari M., Cyckowski L. L., Monroe J. F., Marshall K. A., Chung D. C., Auricchio A., Simonelli F.; และคณะ (2011). "The human visual cortex responds to gene therapy-mediated recovery of retinal function". The Journal of Clinical Investigation. 121 (6): 2160–2168. doi:10.1172/JCI57377. PMC 3104779. PMID 21606598.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Bennett J (2003). "Immune response following intraocular delivery of recombinant viral vectors". Gene therapy. 10 (11): 977–982. doi:10.1038/sj.gt.3302030. PMID 12756418.
- ↑ Tight junction เป็นส่วนของเซลล์สองเซลล์ที่เยื่อหุ้มเซลล์เกิดการเชื่อมต่อกันกลายเป็นส่วนที่สามารถกีดขวางของเหลวไม่ให้ซึมผ่านได้
- ↑ Curace Enrico M., Auricchio Alberto. "Versatility of AAV vectors for retinal gene transfer". Vision Research. 2008 (48): 353–359.
- ↑ Anneke , Roepmana Ronald, Koenekoopb Robert K., Cremersa Frans P.M. (2008). "Leber congenital amaurosis: Genes, proteins and disease mechanisms". Progress in Retinal and Eye Research. 27 (4): 391–419. doi:10.1016/j.preteyeres.2008.05.003. PMID 18632300.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Rolling F (2004). "Recombinant AAV-mediated gene transfer to the retina: gene therapy perspectives". Gene Therapy. 11: S26–S32. doi:10.1038/sj.gt.3302366. PMID 15454954.
- ↑ Rolling F (2004). "Recombinant AAV-mediated gene transfer to the retina: gene therapy perspectives". Gene Therapy. 11: S26–S32. doi:10.1038/sj.gt.3302366.
- ↑ The Nobel Prize in Physiology or Medicine 1967
- ↑ Calculating the speed of sight - being-human - 28 July 2006 - New Scientist
- ↑ Retinal repair by transplantation of photoreceptor precursors : Abstract : Nature
- ↑ PMID 18329018 (PMID 18329018)
Citation will be completed automatically in a few minutes. Jump the queue or expand by hand - ↑ "About << EyeWire". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2012-02-13. สืบค้นเมื่อ March 26, 2012.
- ↑ "Retina << EyeWire". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2012-03-24. สืบค้นเมื่อ March 27, 2012.
- ↑ "EyeWire". สืบค้นเมื่อ March 27, 2012.
- ↑ Kröger RH, Biehlmaier O (September 2009). "Space-saving advantage of an inverted retina". Vision Res. 49 (18): 2318–21. doi:10.1016/j.visres.2009.07.001. PMID 19591859.
- ↑ Photobiology of the retina http://www.photobiology.info/Rozanowska.html
- ↑ "Diagrammatic representation of disc shedding and phagosome retrieval into the pigment epithelial cell (รูปแผนผังแสดงการปลดทิ้ง disc ส่วนนอกของเซลล์รูปแท่ง และกระบวนการฟาโกไซโทซิสที่นำ disc เข้าไปใน retinal pigment epithelial cell)". สืบค้นเมื่อ 3 มีนาคม 2557.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|accessdate=(help) - ↑ Retinochrome http://jgp.rupress.org/content/65/2/235.full.pdf
- ↑ http://www.australianmuseum.net.au/How-spiders-see-the-world
แหล่งข้อมูลอื่น
แก้- ซานเตียโก รามอน อี กาฆัล, Histologie du Système Nerveux de l'Homme et des Vertébrés, Maloine, Paris, 1911.
- Rodieck RW (1965). "Quantitative analysis of cat retinal ganglion cell response to visual stimuli". Vision Res. 5 (11): 583–601. doi:10.1016/0042-6989(65)90033-7. PMID 5862581.
- Wandell, Brian A. (1995). Foundations of vision. Sunderland, Mass: Sinauer Associates. ISBN 0-87893-853-2.
- Wässle H, Boycott BB (1991). "Functional architecture of the mammalian retina". Physiol Rev. 71 (2): 447–480. PMID 2006220.
- Schulz HL, Goetz T, Kaschkoetoe J, Weber BH (2004). "The Retinome – Defining a reference transcriptome of the adult mammalian retina/retinal pigment epithelium". BMC Genomics (about a transcriptome for eye color). 5 (1): 50. doi:10.1186/1471-2164-5-50. PMC 512282. PMID 15283859.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - Eye, Brain, and Vision - online book - by David Hubel เก็บถาวร 2007-03-14 ที่ เวย์แบ็กแมชชีน
- Kolb, H., Fernandez, E., & Nelson, R. (2003) . Webvision: The neural organization of the vertebrate retina. Salt Lake City, Utah: John Moran Eye Center, University of Utah. Retrieved July 19, 2004.
- Demo: Artificial Retina, MIT Technology Review, September 2004. Reports on implant research at Technology Review
- Successful photoreceptor transplantation, MIT Technology Review, November 2006. How stem cells might restore sight at Technology Review
- Australian Vision Prosthesis Group เก็บถาวร 2011-08-12 ที่ เวย์แบ็กแมชชีน, Graduate School of Biomedical Engineering, University of New South Wales
- RetinaCentral, Genetics and Diseases of the Human Retina at University of Würzburg
- Retinal layers image. NeuroScience 2nd Ed at United States National Library of Medicine
- Jeremy Nathans's seminars: "The Vertebrate Retina: Structure, Function, and Evolution"
- Retina - Cell Centered Database
- ภาพเนื้อเยื่อจากมหาวิทยาลัยบอสตัน 07901loa (อังกฤษ)
- MedlinePlus Encyclopedia 002291