วิตามินบี12
วิตามินบี12 (อังกฤษ: vitamin B12, cobalamin) เป็นวิตามินละลายน้ำได้ที่เป็นกุญแจสำคัญในการทำงานเป็นปกติของสมองกับระบบประสาท และการสร้างเม็ดเลือดแดง เป็นรูปแบบหนึ่งของวิตามินบี 8 อย่าง ที่เกี่ยวข้องกับกระบวนการเมแทบอลิซึมในเซลล์ทุกเซลล์ในร่างกายมนุษย์ โดยมีผลเฉพาะต่อการสังเคราะห์ดีเอ็นเอ เมแทบอลิซึมของกรดไขมันและกรดอะมิโน[1] ไม่มีเห็ดรา พืช หรือสัตว์ (รวมทั้งมนุษย์) ที่สามารถสร้างวิตามินบี12ได้ มีแต่สิ่งมีชีวิตประเภทแบคทีเรียและอาร์เคียที่มีเอนไซม์เพื่อสังเคราะห์มันได้ แหล่งของวิตามินที่ได้พิสูจน์แล้วเป็นผลิตภัณฑ์สัตว์รวมทั้งเนื้อ ปลา ผลิตภัณฑ์นม และอาหารเสริม แต่ก็มีงานวิจัยที่แสดงว่า ผลิตภัณฑ์ที่ไม่ใช่มาจากสัตว์บางอย่างอาจเป็นแหล่งธรรมชาติของวิตามินได้ เพราะอยู่ร่วมกับแบคทีเรีย (bacterial symbiosis) วิตามินบี12 เป็นวิตามินที่ใหญ่ที่สุด มีโครงสร้างซับซ้อนที่สุด และสามารถสังเคราะห์โดยหมักแบคทีเรีย (bacterial fermentation-synthesis) แล้วใช้เสริมอาหารและเป็นวิตามินเสริม
 | |
| ข้อมูลทางคลินิก | |
|---|---|
| AHFS/Drugs.com | Vitamin B12 |
| ช่องทางการรับยา | ทางปาก ทางเส้นเลือด ฉีดในกล้ามเนื้อ ทางจมูก |
| รหัส ATC | |
| กฏหมาย | |
| สถานะตามกฏหมาย | |
| ข้อมูลเภสัชจลนศาสตร์ | |
| ชีวประสิทธิผล | ดูดซึมที่ลำไส้เล็กส่วนปลาย |
| การจับกับโปรตีน | มีสัมพรรคภาพสูงกับโปรตีน transcobalamins ในเลือด สัมพรรคภาพสำหรับ hydroxocobalamin จะสูงกว่า cyanocobalamin |
| การเปลี่ยนแปลงยา | ตับ |
| ครึ่งชีวิตทางชีวภาพ | ประมาณ 6 วัน (400 วันในตับ) |
| การขับออก | ไต |
| ตัวบ่งชี้ | |
| |
| เลขทะเบียน CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| KEGG | |
| ChEMBL | |
| ข้อมูลทางกายภาพและเคมี | |
| สูตร | C63H88CoN14O14P |
| มวลต่อโมล | 1,355.37 g/mol g·mol−1 |
| แบบจำลอง 3D (JSmol) | |
| |
| |
| | |
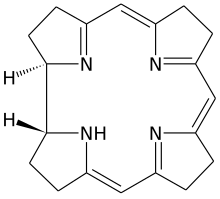

วิตามินบี12 เป็นกลุ่มสารประกอบที่มีโครงสร้างเคมีเกี่ยวข้องกัน (หรือที่เรียกว่า vitamer) ซึ่งมีฤทธิ์ทางชีวภาพ และมีธาตุโคบอลต์ (Co) ที่ไม่สามัญทางเคมี-ชีวภาพ อยู่ตรงกลางวงแหวนเชิงระนาบแบบ tetra-pyrrole ที่เรียกว่าวงแหวน corrin (ดูรูป) ซึ่งสามารถผลิตได้โดยแบคทีเรีย hydroxocobalamin แต่ร่างกายสามารถแปรรูปแบบวิตามินไปในแบบต่าง ๆ ได้ วิตามินค้นพบโดยความสัมพันธ์ของมันกับโรคภาวะเลือดจางเหตุขาดวิตามินบี12 (pernicious anemia) ซึ่งเป็นโรคภูมิต้านตนเอง และมีผลทำลายเซลล์ผนัง (parietal cell) ที่มีหน้าที่หลั่งไกลโคโปรตีน คือ intrinsic factor ในกระเพาะอาหาร เซลล์เหล่านี้ยังมีหน้าที่หลั่งกรดย่อยอาหารในกระเพาะอีกด้วย เพราะว่า intrinsic factor จำเป็นต่อการดูดซึมวิตามินตามปกติ การขาดโปรตีนนี้เพราะโรค จึงทำให้ขาดวิตามินบี12 ยังมีรูปแบบการขาดวิตามินแบบเบากว่าอื่น ๆ ที่ผลติดตามทางชีวเคมีก็ปรากฏชัดแล้ว[2]
การแพทย์
แก้วิตามินบี12 ใช้รักษาการขาดวิตามินบี12 ไซยาไนด์เป็นพิษ และการขาดวิตามินบี12โดยกรรมพันธุ์ (hereditary deficiency of transcobalamin II)[3] เป็นวิตามินที่ให้โดยเป็นส่วนของการวินิจฉัยภาวะเลือดจางเหตุขาดวิตามินบี12 (pernicious anemia) โดย Schilling test[3]
สำหรับไซยาไนด์เป็นพิษ แพทย์จะให้ hydroxocobalamin ทางเส้นเลือดดำและบางครั้งพร้อมกับ sodium thiosulfate ซึ่งใช้เป็นยาแก้พิษไซยาไนต์อีกอย่างหนึ่ง[4] กลไกออกฤทธิ์ตรงไปตรงมา คือ ลิแกนด์ไฮดรอกไซด์ของ hydroxycobalamin จะแทนที่ด้วยไอออนไซยาไนด์ที่เป็นพิษ รวมกันกลายเป็นรูปแบบวิตามินบี12 ที่ไม่มีโทษและสามารถขับออกทางปัสสาวะ ในประเทศสหรัฐอเมริกา องค์การอาหารและยาปี 2549 อนุมัติให้ใช้ hydroxocobalamin เพื่อรักษาพิษของไซยาไนด์แบบฉับพลัน[5]
ประมาณบริโภคอ้างอิง (DRI)
แก้ในปี 2541 คณะกรรมการอาหารและโภชนาการของสถาบันการแพทย์สหรัฐอเมริกาได้อั๊ปเดตค่าประเมินความจำเป็นโดยเฉลี่ย (Estimated Average Requirements, EARs) และค่าเผื่อทางอาหารต่อวัน (Dietary Allowances, RDAs) สำหรับวิตามินบี12 เป็น
- สำหรับหญิงชายอายุ 14 ปีขึ้น EAR อยู่ที่ 2.0 μg/วัน RDA อยู่ที่ 2.4 μg/วัน โดย RDA สูงกว่า EAR เผื่อคนที่ต้องได้มากกว่าโดยเฉลี่ย
- สำหรับหญิงตั้งครรภ์ RDA อยู่ที่ 2.6 μg/วัน
- สำหรับหญิงให้นม RDA อยู่ที่ 2.8 μg/วัน
- สำหรับทารกจนถึง 12 เดือน ค่าปริมาณบริโภคพอ (Adequate Intake, AI) อยู่ที่ 0.4–0.5 μg/วัน
- สำหรับเด็กอายุระหว่าง 1–13 ปี RDA จะเพิ่มตามอายุจาก 0.9–1.8 μg/วัน
- สำหรับบุคคลอายุมากกว่า 50 ปี เพราะว่าประมาณ 10-30% จะไม่สามารถดูดซึมวิตามินบี12 ได้จากอาหารธรรมชาติ จึงแนะนำให้ได้ปริมาณตาม RDA โดยทานอาหารที่เสริมวิตามินบี12 หรือทานวิตามินเสริม
เพื่อความปลอดภัย คณะกรรมการยังตั้งระดับบริโภคทนได้สูงสุด (Tolerable Upper Intake Levels, ULs) สำหรับวิตามินและแร่ธาตุด้วยเมื่อมีหลักฐานเพียงพอ ในกรณีวิตามินบี12 ไม่มีระดับสูงสุดเพราะยังไม่มีข้อมูลในมนุษย์ว่ามีผลลบเมื่อทานมาก และองค์การความปลอดภัยอาหารยุโรป (European Food Safety Authority) ก็ทบทวนเรื่องเดียวกันแล้วสรุปว่า ไม่มีหลักฐานเพื่อตั้งค่าสูงสุดสำหรับวิตามินบี12[6]
ค่า EARs, RDAs, และ ULs เหล่านี้รวม ๆ กันเรียกว่า ปริมาณบริโภคอ้างอิง (Dietary Reference Intake)[7]
ส่วนป้ายอาหารและวิตามินเสริมในสหรัฐจะแสดงค่าเป็นเปอร์เซ็นต์ที่ควรได้ต่อวัน (percent of Daily Value, %DV) สำหรับวิตามินบี12 100% ของ %DV เคยอยู่ที่ 6.0 μg แต่ตั้งแต่เดือนพฤษภาคม 2559 ได้ลดลงเหลือ 2.4 μg
แหล่งจากสาหร่ายที่สร้างความขัดแย้ง
แก้องค์กรต่าง ๆ (รวมทั้ง UK Vegan Society, Vegetarian Resource, และ Physicians Committee for Responsible Medicine) แนะนำผู้ทานอาหารเจแบบวีแกนให้ทานอาหารเสริมวิตามินบี12 อย่างสม่ำเสมอ หรือทานวิตามินเสริมเพื่อได้วิตามินตามที่แนะนำ[8][9][10]
สำหรับผู้ที่ทานอาหารแบบวีแกนที่มีวิตามินบี12 น้อยมาก และบุคคลอื่นที่ต้องการวิตามินจากอาหารนอกจากผลิตภัณฑ์สัตว์ การทานอาหารที่ไม่มีวิตามินเทียม (pseudovitamin-B12) แต่มีวิตามินแบบมีฤทธิ์ทางชีวภาพเป็นเรื่องสำคัญ โดยวิตามินบี12 เทียมหมายถึงสารประกอบที่คล้ายกับวิตามิน แต่ไม่มีฤทธิ์ทางชีวภาพ และก็พบพร้อมกับวิตามินที่มีฤทธิ์ ทั้งในตัวมนุษย์เอง[11] ในอาหารหลายอย่าง (แม้แต่ผลิตภัณฑ์สัตว์[12]) และอาจจากวิตามินเสริมและอาหารที่เสริมวิตามิน[13] ในไซยาโนแบคทีเรียรวมทั้งสาหร่ายเกลียวทอง สาหร่ายอื่น ๆ และสาหร่ายญี่ปุ่น (Porphyra tenera หรือ Asakusa-nori) จะพบวิตามินเทียมเช่นนี้โดยมาก[14]
ยังไม่มีการทดลองในมนุษย์โดยมีขนาดตัวอย่างพอเพื่อเป็นหลักฐานของฤทธิ์เอนไซม์ของวิตามินบี12 ที่มาจากแหล่งอื่นนอกจากแบคทีเรีย เช่น สาหร่ายในสกุล Chlorella และสาหร่ายทะเลที่ทานได้อื่น ๆ แม้ว่า ทางเคมีแล้ว แหล่งเหล่านี้จะรายงานว่ามีรูปแบบวิตามินที่มีโครงสร้างทางเคมีคล้าย ๆ กับวิตามินที่มีฤทธิ์[15]
การขาดวิตามินบี12
แก้การขาดวิตามินบี12 อาจทำให้เสียหายอย่างรุนแรงโดยฟื้นคืนไม่ได้ โดยเฉพาะต่อสมองและระบบประสาท[16] ในระดับที่ต่ำกว่าปกติเพียงเล็กน้อย อาจมีอาการเช่นความล้า อารมณ์ซึมเศร้า และความจำไม่ดี[2] การขาดวิตามินอาจเป็นเหตุของอาการฟุ้งพล่าน (mania) หรืออาการโรคจิต (psychosis)[17][18]
การขาดวิตามินบี12 เกิดจากการทานไม่พออย่างสามัญที่สุด แต่ว่าอาจเกิดจากการดูดซึมได้ไม่ดี โรคทางลำไส้บางอย่าง การมีโปรตีนยึดเหนี่ยว (binding protein) น้อย หรือเมื่อใช้ยาบางประเภท วิตามินมีน้อยมากในพืช และดังนั้น คนที่ทานเจมีโอกาสขาดวิตามินสูงสุด ทารกจะเสี่ยงขาดวิตามินสูงกว่าถ้าแม่ทานเจ ผู้สูงอายุที่จำกัดการทานผลิตภัณฑ์สัตว์เป็นกลุ่มที่เสี่ยงอีกกลุ่มหนึ่ง[19]
การขาดวิตามินบี12 สามารถปรากฏเป็นภาวะเลือดจาง ในบางกรณี การขาดวิตามินอาจทำให้เสียหายอย่างถาวร มีงานศึกษาเมื่อไม่นานที่สัมพันธ์ความซึมเศร้ากับการขาดวิตามินบี12
การมีวิตามินบี12 ในระดับที่เพียงพอ ยังสัมพันธ์อย่างอิสระกับการลดความเสี่ยงต่อโรคซึมเศร้าและกับการรู้คิดที่ดีกว่าแม้เมื่อควบคุมตัวแปรกวนแล้ว[20] วิตามินเป็นซับสเตรตของปฏิกิริยาในเซลล์หลายอย่าง รวมทั้งการสังเคราะห์กรดนิวคลีอิกและสารสื่อประสาทที่อาศัยกระบวนการ methylation และการสังเคราะห์สารสื่อประสาททั้ง 3 อย่าง (รวมทั้งเซโรโทนิน นอร์เอพิเนฟริน และโดพามีน) สามารถช่วยเพิ่มผลของยาแก้ซึมเศร้าที่ใช้โดยปกติ[21]
ระดับวิตามินภายในเซลล์สามารถอนุมานได้จากความเข้มข้นของ homocysteine ในเลือด ซึ่งจะเปลี่ยนเป็น methionine ผ่านปฏิกิริยาทางเอนไซม์ที่ใช้ 5-methyltetrahydrofolate เป็นตัวให้ methyl ดังนั้น ระดับ homocysteine ในลือดจะลดลงเมื่อระดับวิตามินบี12 ในเซลล์สูงขึ้น นอกจากนั้นแล้ว เพราะว่าเมแทบอไลต์ที่ออกฤทธิ์ของวิตามินจำเป็นในกระบวนการ methylation ของ homocysteine เพื่อผลิต methionine ซึ่งเป็นกรดอะมิโนที่มีบทบาทในกระบวนการทางเคมี-ชีวภาพของการสร้างและสลายสารสื่อประสาทประเภทโมโนอะมีน ดังนั้น การขาดวิตามินจึงอาจมีผลต่อการผลิตและการทำงานของสารสื่อประสาทเหล่านั้น[22] นอกจากโฮโมซิสเทอีน (homocysteine) แล้ว กรดเมทิลมาโลนิกในปัสสาวะหรือในพลาสมาก็เป็นตัวบ่งชี้ระดับวิตามินบี 12 ที่สำคัญอีกตัว ซึ่งจะเพิ่มขึ้นเมื่อขาดวิตามินบี 12[23] อย่างไรก็ตาม ระดับของกรดเมทิลมาโลนิกที่เพิ่มขึ้นอาจบ่งบอกถึงความผิดปกติของระบบเมตาบอลิซึมที่มักถูกมองข้ามก็อาจเป็นได้[24] นั่นคือภาวะกรดมาโลนิกและกรดเมทิลมาโลนิกในปัสสาวะ (Combined malonic and methylmalonic aciduria, CMAMMA)[25]
แหล่ง
แก้จากสัตว์
แก้วิตามินบี12 พบในผลิตภัณฑ์สัตว์โดยมาก รวมทั้งปลาและหอย เนื้อ (โดยเฉพาะตับ) ไก่ ไข่ นม และผลิตภัณฑ์นม[2] แต่การดูดซึมวิตามินจากไข่น้อยกว่า 9% เทียบกับ 40% – 60% จากปลา สัตว์ปีก และเนื้อ[26] สถาบันสุขภาพแห่งชาติสหรัฐ (NIH) ซึ่งกำหนดการได้วิตามิน 100% ต่อวันที่ 6 μg/วัน แสดงแหล่งวิตามินจากสัตว์ต่าง ๆ ดังต่อไปนี้[2]
| แหล่ง | % |
|---|---|
| หอยกาบ 85 ก. (เกือบขีด) | 1,402% |
| ตับวัว 85 ก. | 1,178% |
| ซีเรียวเสริมวิตามิน 100% | 100% |
| ปลาเรนโบว์เทราต์ไม่เลี้ยง 85 ก | 50% |
| ปลาแซลมอนซ็อกอาย 85 ก | 80% |
| ปลาเรนโบว์เทราต์เลี้ยง 85 ก | 58% |
| ปลาทูน่ากระป๋องใส่น้ำ 85 ก | 42% |
| ชีสเบอร์เกอร์เนื้อสองชั้น | 35% |
| ซีเรียวเสริมวิตามิน 25% | 25% |
| เนื้อวัวสันนอก 85 ก | 23% |
| นมไขมันต่ำ 1 ถ้วยตวง | 18% |
| โยเกิร์ตผลไม้ไขมันต่ำ 227 ก. | 18% |
| สวิสชีส 28 ก. | 15% |
| แฮมย่าง 90 ก. | 10% |
| ไข่ 1 ฟองใหญ่ ต้มสุก | 10% |
| อกไก่ย่าง 90 ก. | 5% |
นิตยสารชีวจิตรายงานว่าอาหารหมักดอง เช่น กะปิ น้ำปลา เต้าเจี้ยว ก็เป็นแหล่งวิตามินบี12 ด้วย[27]
อาหารเสริมวิตามิน
แก้อาหารที่เสริมวิตามินบี12 สามารถเป็นแหล่งวิตามินทุกวันได้ด้วย อาหารที่เสริมวิตามินบี12 อาจรวมซีเรียวอาหารเช้า ผลิตภัณฑ์ถั่วเหลือง องค์กรต่าง ๆ (รวมทั้ง UK Vegan Society, Vegetarian Resource, และ Physicians Committee for Responsible Medicine) แนะนำให้ผู้ทานอาหารเจแบบวีแกนที่ได้วิตามินจากอาหารเสริมวิตามินไม่พอให้ทานวิตามินเสริม[28][9][10]
วิตามินเสริม
แก้วิตามินบี12 เป็นส่วนประกอบของวิตามินรวมและในบางประเทศ อาหารประเภทธัญพืชจะเสริมวิตามินด้วย เช่น ขนมปังและพาสตา ในสหรัฐอเมริกา ผลิตภัณฑ์ที่ไม่ต้องสั่งโดยแพทย์สามารถซื้อได้โดยมีขนาดจนถึง 5,000 µg/ต่อการรับประทาน เป็นส่วนผสมสามัญของเครื่องดื่มที่ให้กำลัง โดยปกติมีขนาดหลายเท่าจากปริมาณวิตามินที่แนะนำแต่ละวัน (RDA) ยังมีผลิตภัณฑ์ที่แพทย์ต้องสั่งไม่ว่าจะทางการฉีดหรืออื่น ๆ
การดูดซึมจากใต้ลิ้นโดยตรงยังไม่มีหลักฐานว่าจำเป็นหรือมีประโยชน์ แม้ว่าจะมียาและแม้แต่วิตามินเสริมที่ทำเป็นรูปขนมอมยิ้มที่ขายสำหรับให้ดูดซึมใต้ลิ้น งานศึกษาปี 2546 ไม่พบความแตกต่างที่สำคัญในการดูดซึมเข้าเลือดระหว่างที่ทานหรือที่ "ดูดซึมใต้ลิ้น" สำหรับวิตามมิน (cobalamin) ขนาด 0.5 มก.[29] การเสริมวิตามินใต้ลิ้นมีผลก็เพียงเพราะว่ามีขนาดสูง (0.5 มก.) และในที่สุดก็ต้องกลืน ไม่ใช่เป็นอะไรที่ดีกว่ายาทาน
ดังจะกล่าวต่อไป ขนาดที่สูงของยาทานอาจมีประสิทธิผลในการรักษา แม้ว่า จะมีปัญหาการดูดซึมวิตามินจากทางเดินอาหาร เช่นที่เกิดจาก กระเพาะฝ่อ (จาก pernicious anemia) การฉีดและแผ่นแนบผิวบางครั้งจะใช้ถ้ามีปัญหาการดูดซึม แต่ก็มีหลักฐานว่าวิธีเช่นนี้อาจไม่จำเป็นเพราะขนาดสูงของวิตามินที่ใช้ในปัจจุบัน (เช่น 0.5-1 มก. หรือมากกว่านั้น) แม้แต่โรค pernicious anemia เอง (ภาวะเลือดจางเหตุขาดวิตามินบี12) ก็ยังรักษาได้โดยใช้ทาน[30][31][32] คือวิตามินเช่นนี้มีขนาดสูงจนกระทั่งว่าประมาณ 1–5% ของผลึกวิตามินที่ไม่ได้ยึดกับอะไรจะดูดซึมเข้าไปในทางเดินอาหารผ่านการแพร่ที่ไม่ต้องทำอะไร (passive diffusion) แต่ว่า ถ้าคนไข้มี methyltransfer pathway (คือ cobalamin C disease, combined methylmalonic aciduria และ homocystinuria) ผิดปกติแต่กำเนิด การรักษาทางเส้นเลือด, การฉีดยา hydroxocobalamin เข้าในกล้ามเนื้อ, หรือการให้วิตามินผ่านผิวหนังอาจจำเป็น[33][34][35][36][37]
วิตามินเสริมที่ไม่มีไซยาไนด์
แก้เมื่อเร็ว ๆ นี้เริ่มมีการขายวิตามิน methylcobalamin ที่ให้ทางลิ้นในขนาด 5 มก. กระบวนการเมแทบอลิซึมและการกระจายตัวของ methylcobalamin คาดว่าจะเหมือนกับรูปแบบอื่น ๆ ของวิตามินบี12[38] แม้จะไม่มีการปล่อยไซยาไนด์ แต่ว่า ปริมาณไซยาไนด์ที่ปล่อย (ที่ 20 µg สำหรับวิตามิน cyanocobalamin ขนาด 1,000 µg) จริง ๆ ก็ยังน้อยกว่าที่บริโภคจากอาหารอย่างอื่น ๆ แต่ละวัน ความปลอดภัยของวิตามินบี12ทุกรูปแบบมีหลักฐานชัดเจนแล้ว[38]
แหล่งวิตามินที่ยังขัดแย้ง
แก้นอกจากอาหารหมักบางอย่างแล้ว[39][40] มีพืช เห็ดรา และสาหร่าย จำนวนน้อยมากที่มีวิตามินบี12 ที่มีฤทธิ์ทางชีวภาพ และทั้งหมดเหล่านี้ไม่เคยได้ทดสอบในมนุษย์ โดยสาหร่ายเกลียวทอง (spirulina) และสาหร่ายแห้งญี่ปุ่นพันธุ์ Porphyra tenera (Asakusa-nori) พบโดยมากว่ามีแต่วิตามินบี12 เทียม ไม่ใช่เป็นวิตามินที่มีฤทธิ์ทางชีวภาพ[14][41]
ระดับวิตามินบี12 สูงในเลือด
แก้การมีระดับวิตามินบี12 หรือ cobalamin สูง (คือสูงกว่า 600 pmol/L) โดยไม่ได้ทานเสริมอาจเป็นอาการของโรคที่รุนแรง แต่ว่าในกรณีเช่นนี้ เชื่อว่า วิตามินเป็นตัวบ่งโรค ไม่ใช่เหตุ เหตุอย่างหนึ่งของการมีระดับวิตามินสูงก็คือการมีโรคตับทั่วไป เนื่องจากการแยกสลายเซลล์ตับ (hepatic cytolysis) จะปล่อยวิตามินออกในเลือด และตับที่มีปัญหาจะกำจัดวิตามินได้น้อยกว่า ดังนั้น ตับอักเสบ ตับแข็ง มะเร็งเซลล์ตับ โรคตับเหตุการแพร่กระจายของเนื้อร้าย (metastatic liver disease) สามารถมาพร้อมกับระดับวิตามินที่สูงขึ้น
ได้มีการเสนอว่า ระดับวิตามินบี12 ที่สูงขึ้นในเลือดเป็นตัวพยากรณ์ความเสี่ยงตายในห้องไอซียู แต่งานวิจัยปี 2557 แสดงว่า "ระดับวิตามินบี12 ที่สูงขึ้นไม่ได้เป็นตัวพยากรณ์อัตราการตายที่สำคัญหลังจากรับเข้าห้องไอซียู เมื่อควบคุมการทำงานของตับแล้ว แต่อาจเป็นตัวบ่งชี้ว่าตับทำงานได้ไม่ดี"[42]
คนไข้กลุ่มสองที่ไม่ได้ทานวิตามินเสริมแต่มีระดับ cobalamin สูงมีเหตุจากการผลิตโปรตีนขนส่งวิตามินบี12 คือ haptocorrin และ transcobalamin II มากกว่าปกติ[43] ซึ่งเกิดขึ้นในโรคเลือดบางอย่าง เช่น มะเร็งเม็ดเลือดขาวเรื้อรังชนิดไมอิลอยด์ (chronic myelogeneous leukemia), มะเร็งเม็ดเลือดขาวชนิดโปรไมอิโลไซติก (promyelocytic leukemia), โพลีไซทีเมีย เวอรา, และกลุ่มอาการอีโอซิโนฟิลมากเกิน (hypereosinophilic syndrome) ระดับ cobalamin ที่สูงขึ้นยังเป็นเกณฑ์วินิจฉัยโรคสองอย่างสุดท้ายอีกด้วย
คนไข้กลุ่มที่สามที่มีระดับ cobalamin สูงโดยไม่ได้เสริม (> 600 pmol/L) อาจมีความเสี่ยงสูงขึ้นต่อมะเร็งเนื่องจากสูบบุหรี่หรือดื่มสุราโดยไม่ใช่โรคเลือด (โดยมากจะได้วินิจฉัยมะเร็งภายใน 1 ปีหลังจากตรวจเจอวิตามินสูง) ในการศึกษาประชากร 333,000 คนในประเทศเดนมาร์ก คนที่มีระดับวิตามินบี12 สูงมีโอกาสเกิดมะเร็งบางอย่างสูงกว่า 3–6 เท่าของคนที่มีระดับปกติ[44]
ดังนั้น งานทบทวนวรรณกรรมปี 2546 จึงอ้างว่า "โดยรวมแล้ว สามารถสรุปได้ว่าระดับ cobalamin ที่สูงขึ้นในเลือดสมควรตรวจสอบอย่างเต็มที่เพื่อประเมินว่าอาจมีโรคหรือไม่"[45]
ปฏิสัมพันธ์กับสารอื่น ๆ
แก้วิตามินบี12 อาจมีปฏิสัมพันธ์กับยาที่หมอสั่งต่าง ๆ[2] รวมทั้ง
- ยารักษาโรคในกระเพาะประเภท H2-receptor antagonist รวมทั้งไซเมทิดีน ฟาโมทิดีน นิซาทิดีน และแรนิทิดีน ระดับกรดในกระเพาะและเอนไซม์เพพซินที่ลดลงเหตุยา อาจลดการดูดซึมวิตามินบี12 ที่ยึดอยู่กับโปรตีนในอาหาร แต่จะไม่ลดระดับการดูดซึมวิตามินเสริม เพราะว่า ต้องมีกรดในกระเพาะเพื่อจะย่อยวิตามินออกจากโปรตีนที่ยึดวิตามินเพื่อให้ดูดซึมได้ ส่วนการขาดวิตามินบี12 ในระดับที่แสดงอาการสำคัญ และภาวะเลือดจางแบบเม็ดเลือดโต (megaloblastic anemia) เพราะเหตุนี้มีโอกาสน้อย ยกเว้นถ้าใช้ยาเป็นเวลานาน (2 ปีหรือมากกว่านั้น) หรือว่ามีโภชนาการที่ไม่ดี และจะมีโอกาสสูงยิ่งขึ้นสำหรับคนที่เกิดภาวะไร้กรดเกลือ (achlorhydria) คือกระเพาะไม่หลั่งกรดเลย ซึ่งเกิดขึ้นบ่อยกว่าในคนที่ใช้กลุ่มยา proton pump inhibitor ดังนั้น ระดับวิตามินจึงควรสอดส่องในบุคคลที่ใช้ยา H2 blocker ในขนาดสูงเป็นระยะเวลานาน
- เมตฟอร์มิน อาจลดระดับกรดโฟลิกและวิตามินบี12 ในเลือด การใช้ยาในขนาดสำคัญเป็นระยะเวลานานเพิ่มความเสี่ยงการขาดวิตามินบี12 และสำหรับคนไข้ที่ขาด การมี homocysteine เกิน (hyperhomocysteinemia) เป็น "ปัจจัยเสี่ยงอิสระต่อโรคหัวใจ โดยเฉพาะในบุคคลที่มีโรคเบาหวานประเภท 2"[46] มีรายงานแม้จะน้อยของภาวะเลือดจางแบบเม็ดเลือดโต (megaloblastic anemia) สำหรับบุคคลที่ทานยา 5 ปีขึ้นไป ระดับวิตามินที่ลดลงเกิดใน 30% สำหรับบุคคลที่ทานยาเป็นประจำ[47][48] แต่ว่าการขาดวิตามินในระดับที่ปรากฏอาการมีโอกาสน้อยถ้าทานวิตามินพอ การขาดสามารถแก้ได้โดยให้วิตามินบี12 เสริมแม้จะใช้ยาต่อไป ส่วนภาวะการดูดซึมวิตามินบี12 ได้ไม่ดีเนื่องจากยา สามารถแก้ได้โดยให้แคลเซียมทานเสริม[49] ความสำคัญทางคลินิกโดยทั่วไปของยาต่อระดับวิตามินบี12 ยังเป็นเรื่องไม่ชัดเจน[50]
- ยายับยั้งการหลั่งกรด (PPIs) รวมทั้งโอมีปราโซล, lansoprazole, ราบีปราโซล, pantoprazole, และ esomeprazole คือ ระดับกรดในกระเพาะและเพพซินที่ลดลงเนื่องจาก PPIs สามารถลดการดูดซึมวิตามินบี12 ที่ยึดกับโปรตีนได้ แต่จะไม่ลดการดูดซึมวิตามินเสริม (ที่ไม่ได้ยึดกับโปรตีน) เพราะว่า กรดกระเพาะอาหารจำเป็นเพื่อย่อยวิตามินออกจากโปรตีนที่ยึดกับวิตามินเพื่อการดูดซึม ระดับวิตามินที่ลดลงอาจสามัญสำหรับ PPIs มากกว่า H2-blocker เพราะว่า PPIs มีโอกาสทำให้เกิดภาวะไร้กรดเกลือ (achlorhydria) สูงกว่า ซึ่งกรดกระเพาะอาหารไม่หลั่งออกโดยสิ้นเชิง แต่การขาดวิตามินที่มีนัยสำคัญทางคลินิกมีโอกาสน้อย นอกจากใช้ยาเป็ระยะเวลานาน (2 ปีหรือมากกว่านั้น) หรือทานวิตามินไม่พอ ดังนั้น ควรสอดส่องระดับวิตามินบี12 ในคนไข้ที่ใช้ยา PPIs ขนาดสูงเป็นระยะเวลานาน
โครงสร้าง
แก้วิตามินบี12 มีโครงสร้างซับซ้อนที่สุดในบรรดาวิตามินทั้งหมด โดยโครงพื้นฐานเป็นวงแหวน corrin ซึ่งคล้ายกับวางแหวน porphyrin ที่พบใน heme, คลอโรฟิลล์, และ cytochrome และมีไอออนโลหะอยู่ตรงกลาง คือ โคบอลต์ จุด coordination 4/6 ของวิตามินอยู่ที่วงแหวน corrin จุดที่ 5 ที่กลุ่ม dimethylbenzimidazole ส่วนจุด coordination ที่ 6 ซึ่งเป็นศูนย์กลางปฏิกิริยา สามารถแปรได้ โดยอาจเป็นกลุ่ม cyano (-CN), กลุ่มไฮดรอกซิล (-OH), กลุ่ม methyl (-CH3), หรือกลุ่ม 5'-deoxyadenosyl ซึ่งความต่างเหล่านี้ทำให้เกิดรูปแบบของวิตามินทั้ง 4 อย่างดังจะกล่าวต่อไป โดยประวัติแล้ว พันธะโคเวเลนต์ระหว่างคาร์บอน-โคบอลต์ เป็นตัวอย่างของพันธะระหว่างคาร์บอน-โลหะแรกที่พบในชีววิทยา เอนไซม์ hydrogenase และอื่น ๆ ที่เกี่ยวข้องกับการใช้โคบอลต์ จะต้องเกี่ยวข้องในเรื่องพันธะระหว่างคาร์บอน-โลหะด้วย[51] ดังนั้น คำว่าวิตามินบี12 จึงเป็นคำทั่วไปหมายถึงโมเลกุลประกอบด้วยโคบอลต์และวงแหวน corrin ที่มีหน้าที่โดยเฉพาะในร่างกาย ซับสเตรตของโมเลกุลโคบอลต์-วงแหวน corrin ที่เป็นพื้นฐานของวิตามินบี12 แบคทีเรียต้องเป็นตัวสังเคราะห์ หลังจากการสังเคราะห์ ยกเว้นในกรณีที่มีน้อย ร่างกายมนุษย์จะสามารถเปลี่ยนรูปแบบใดแบบหนึ่งของวิตามินบี12 ไปเป็นแบบที่มีฤทธิ์ โดยใช้เอนไซม์กลุ่มพรอสเทติก (กลุ่มที่ไม่ใช่โปรตีนที่เชื่อมอยู่กับโปรตีน) ออกจากอะตอมของโคบอลต์ แล้วแทนที่มันด้วยกลุ่มอื่น รูปแบบทั้ง 4 ของวิตามินบี12 (หรือที่เรียกว่า vitamer) เป็นผลึกสีแดงเข้มเมื่อละลายน้ำ เนื่องจากสีของคอมเพล็กซ์โคบอลต์-วงแหวน corrin
cyanocobalamin เป็นรูปแบบอย่างหนึ่งเช่นนี้ของวิตามินบี12 เพราะสามารถสร้างและสลายในร่างกายให้เป็น coenzyme ที่มีฤทธิ์ แต่ว่า รูปแบบนี้ไม่มีอยู่ตามธรรมชาติโดยปกติ แต่เป็นผลของรูปแบบอื่นที่ชอบเข้ายึดไซยาไนด์ เช่นเมื่อใช้ถ่านกัมมันต์ทำวิตามินที่ผลิตจากแบคทีเรียให้บริสุทธิ์ เนื่องจาก cyanocobalamin ตกผลึกง่ายและไม่ไวต่อออกซิเดชันกับอากาศ จึงมักใช้รูปแบบนี้ในการเสริมอาหารหรือในวิตามินรวมต่าง ๆ cyanocobalamin บริสุทธิ์จะมีสีชมพูเข้มที่มาจากคอมเพล็กซ์โคบอลต์รูปแปดเหลี่ยม ซึ่งมีผลึกที่ทำให้งอกได้เป็นระดับมิลลิเมตร
hydroxocobalamin เป็นอีกรูปแบบหนึ่งของวิตามิน แต่ปกติจะไม่มีในร่างกายมนุษย์ และบางครั้งเรียกว่าเป็นวิตามินบี12a นี่เป็นรูปแบบที่ผลิตโดยแบคทีเรีย แต่จะเปลี่ยนเป็น cyanocobalmin เมื่อผ่านกระบวนการทำให้บริสุทธิ์โดยใช้ถ่าน hydroxocobalamin ชอบเข้ายึดกับไอออนไซยาไนด์มาก และดังนั้นจึงใช้เพื่อแก้พิษไซยาไนด์ ซึ่งมักจะผลิตเป็นรูปยาน้ำเพื่อใช้ฉีด hydroxocobalamin เชื่อว่า เปลี่ยนเป็นรูปแบบเอนไซม์ที่มีฤทธิ์ของวิตามินได้ง่ายกว่า cyanocobalamin มักจะแพงกว่า และดำรงอยู่ในร่างกายได้นานกว่า จึงมักใช้รูปแบบนี้ในกรณีที่ต้องมั่นใจว่าวิตามินจะมีฤทธิ์ การฉีด hydroxocobalamin ในกล้ามเนื้อมักใช้สำหรับเด็กที่มีปัญหาเมแทบอลิซึมกับวิตามินบี12 สำหรับผู้ขาดวิตามินที่ตามัวเพราะสูบบุหรี่ (ซึ่งเชื่อว่า บุหรี่อาจเป็นพิษให้เกิดไซยาไนด์) และสำหรับคนไข้ pernicious anemia ที่มีโรคเส้นประสาทตา (optic neuropathy)
ส่วนวิตามินแบบ adenosylcobalamin (adoB12) และ methylcobalamin (MeB12) เป็นรูปแบบของ cofactor ที่มีฤทธิ์ทางเอนไซม์ และมีอยู่โดยธรรมชาติในร่างกาย ร่างกายสะสม adoB12 ไว้โดยมากในตับ ซึ่งสามารถเปลี่ยนเป็น methylcobalamin ตามต้องการ
การสังเคราะห์ในการผลิต
แก้ไม่มีพืชหรือสัตว์ที่สามารถสร้างวิตามินบี12 ได้โดยตนเอง[52] มีแต่สิ่งมีชีวิตแบบแบคทีเรีย และอาร์เคียเท่านั้น[53] ที่มีเอนไซม์ในการสังเคราะห์วิตามินทางชีวภาพ กระบวนการสังเคราะห์วิตามินบี12 เต็มรูปแบบรายงานเป็นครั้งแรก โดยคู่นักเคมีชาวอเมริกันและชาวสวิสในปี 2515[54][55][56] ซึ่งก็ยังคงเป็นงานคลาสสิกในเรื่องการสังเคราะห์ทางอินทรีย์ สปีชีส์จากสิ่งมีชีวิตเหล่าที่รู้ว่าสามารถสังเคราะห์วิตามินบี12 ได้คือ Acetobacterium, Aerobacter, Agrobacterium, Alcaligenes, Azotobacter, Bacillus, Clostridium, Corynebacterium, Flavobacterium, Lactobacillus, Micromonospora, Mycobacterium, Nocardia, Propionibacterium, Protaminobacter, Proteus, Pseudomonas, Rhizobium, Salmonella, Serratia, Streptomyces, Streptococcus และ Xanthomonas การผลิตวิตามินบี12 ทำโดยหมักจุลินทรีย์ที่เลือกอย่างใดอย่างหนึ่ง[57]
Streptomyces griseus ซึ่งเป็นแบคทีเรียที่เคยคิดว่าเป็นยีสต์ เป็นแหล่งผลิตวิตามินบี12 หลักเป็นเวลาหลายปี[58][59] แต่ปัจจุบันมักจะใช้ Pseudomonas denitrificans และ Propionibacterium freudenreichii subsp. shermanii[60] แบคทีเรียเหล่านี้บ่อยครั้งเลี้ยงอย่างพิเศษเพื่อเพิ่มผลผลิต และบริษัทอย่างน้อยหนึ่งแห่ง (เช่น Sanofi-Aventis) ใช้แบคทีเรียที่ผ่านพันธุวิศวกรรม[61] แต่เนื่องจากว่า สปีชีส์ต่าง ๆ ของ Propionibacterium ไม่มีพิษทั้งภายในและภายนอกแบคทีเรีย และพิจารณาว่าปลอดภัยโดยทั่วไป (generally regarded as safe หรือได้สถานะ GRAS) โดยองค์การอาหารและยาสหรัฐ จึงเป็นแบคทีเรียประเภทที่องค์กรให้ความเชื่อใจมากกว่า (preferred) ในการผลิตวิตามินบี12[62]
บริษัท 4 บริษัท ทั่วโลก (คือบริษัทฝรั่งเศส Sanofi-Aventis และบริษัทจีน 3 บริษัท) เชื่อว่าผลิตวิตามินบี12 รวมกันเป็นจำนวน 35 ตันในปี 2551[63]
กลไกออกฤทธิ์
แก้วิตามินบี12 ทำหน้าที่เป็น coenzyme ซึ่งหมายความว่า มันจำเป็นในปฏิกิริยาทางเคมีที่เร่งโดยเอนไซม์[64][65] มีเอนไซม์ 3 กลุ่มที่ใช้วิตามินเป็น coenzyme คือ
- Isomerases
- Methyltransferases
- การย้ายกลุ่ม Methyl (-CH3) ระหว่างโมเลกุล 2 โมเลกุล ซึ่งใช้วิตามินในรูปแบบ MeB12 (methylcobalamin)
- Dehalogenases
- เป็นปฏิกิริยาที่ดึงอะตอมของธาตุกลุ่ม halogen จากโมเลกุลอินทรีย์โมเลกุลหนึ่ง แต่เอนไซม์แบบนี้ในมนุษย์ยังไม่ได้ระบุ
ในมนุษย์ มีกลุ่มเอนไซม์สองกลุ่มที่ต้องอาศัยวิตามินในปฏิกิริยา 2 อย่างแรกที่กล่าว โดยมีเอนไซม์โดยเฉพาะเป็นตัวอย่างดังต่อนี้
(1) Methylmalonyl Coenzyme A mutase (MUT) เป็นเอนไซม์แบบ isomerase ซึ่งใช้วิตามินในรูป AdoB12 และปฏิกิริยาแบบที่ 1 เพื่อเรียงโครงสร้างคาร์บอนใหม่ โดยมีกลุ่ม X เป็น -COSCoA ปฏิกิริยาของ MUT จะเปลี่ยน methylmalonyl-CoA (MMl-CoA) เป็น succinyl-CoA (Su-CoA) ซึ่งเป็นขั้นตอนสำคัญเพื่อดึงพลังงานจากโปรตีนและไขมัน กระบวนการนี้จะพิการเมื่อขาดวิตามินบี12 โดยสามารถวัดระดับ methylmalonic acid (MMA) ที่สูงขึ้นในเลือดได้ แต่ก็น่าเสียดายว่า ระดับ MMA ที่สูงขึ้น แม้จะไวต่อการขาดวิตามินบี12 แต่ก็น่าจะไวเกิน เพราะทุกคนที่ระดับ MMA สูงไม่ได้ขาดวิตามิน ยกตัวอย่างเช่น MMA จะสูงในคนไข้ 90–98% ที่ขาดวิตามิน และคนอายุเกิน 70 ปี 20–25% จะมีระดับ MMA สูงขึ้น แต่ว่า 25–33% ไม่ได้ขาดวิตามิน เพราะเหตุนี้ การประเมินระดับ MMA เป็นปกติจึงไม่แนะนำในผู้สูงอายุ ไม่มีการทดสอบ "มาตรฐานทอง" สำหรับการขาดวิตามินบี12 เพราะว่า แม้จะเริ่มขาดวิตามิน ระดับในเลือดก็ยังอาจปกติในขณะที่การสะสมในเนื้อเยื่อค่อย ๆ พร่องลง ดังนั้น ระดับวิตามินในเลือดที่สูงกว่าเกณฑ์ต่ำสุดไม่ได้บ่งว่าไม่ขาด กระบวนการ MUT จำเป็นในการสังเคราะห์ปลอกไมอีลิน (ดูกลไกตามที่จะกล่าวต่อไป) ซึ่งโฟเลตไม่มีส่วน
(2) 5-methyltetrahydrofolate-homocysteine methyltransferase (MTR) หรือรู้จักว่า methionine synthase เป็นเอนไซม์ methyltransferase ที่ใช้วิตามินในรูปแบบ MeB12 และปฏิกิริยาแบบ 2 เพื่อย้ายกลุ่ม methyl จาก 5-methyltetrahydrofolate ไปยัง homocysteine แล้วสร้าง tetrahydrofolate (THF) และ methionine[66] ซึ่งเป็นปฏิกิริยาที่เสียไปเมื่อขาดวิตามินบี12 มีผลเป็นระดับ homocysteine ที่สูงขึ้น และเป็นโฟเลตติดกับดักอยู่ในรูป 5-methyl-tetrahydrofolate โดยไม่สามารถเปลี่ยนเป็น THF (ซึ่งเป็นโฟเลตแบบที่มีฤทธิ์) ซึ่งมีบทบาทสำคัญในการสังเคราะห์ดีเอ็นเอ และดังนั้น ระดับ THF ที่ลดลงจะทำให้ไม่สามารถสร้างเซลล์ที่ผันเวียนอย่างรวดเร็วได้อย่างมีประสิทธิภาพ โดยเฉพาะเม็ดเลือดแดงและเซลล์ผนังลำไส้ที่มีหน้าที่ดูดซึมอาหาร เพราะว่า กระบวนการ MTR สามารถสร้าง THF ใหม่ก็ได้ หรือโฟเลตใหม่อาจได้จากอาหารก็ได้ ดังนั้นผลเกี่ยวกับการสังเคราะห์ดีเอ็นเอจากการขาดวิตามินบี12 รวมทั้งภาวะเลือดจางแบบเม็ดเลือดใหญ่ (megaloblastic anemia) ซึ่งปรากฏใน pernicious anemia จะหายถ้าทานโฟเลตเพียงพอ และดังนั้น หน้าที่ที่รู้จักดีที่สุดของวิตามินบี12 (รวมทั้งการสังเคราะห์ดีเอ็นเอ การแบ่งเซลล์ และภาวะเลือดจาง) ความจริงเป็นการอำนวยให้เกิดโฟเลตในรูปแบบที่มีฤทธิ์ซึ่งจำเป็นในการผลิตดีเอ็นเอที่มีประสิทธิภาพ[67] นอกจากนั้นแล้ว เอนไซม์ย้ายกลุ่ม methyl อย่างอื่นที่จำเป็นต้องได้วิตามินบี12 เป็น coenzyme ก็ยังมีอีกในแบคทีเรีย เช่น Me-H4-MPT, coenzyme M methyltransferase
หน้าที่เป็นเอนไซม์
แก้ในปฏิกิริยาทางเอนไซม์สองอย่างที่ต้องมีวิตามินบี12 ในมนุษย์ ถ้ามีโฟเลตมาก ปฏิกิริยากลุ่ม Methylmalonyl-CoA mutase (MUT) จะได้รับผลโดยตรงและข้างเคียงที่ชัดเจนที่สุด โดยมีผลต่อระบบประสาท (ดังจะกล่าวต่อไป) นี่เป็นเพราะว่า ปฏิกิริยาแบบ MTR เป็นเพียงการสร้างโฟเลตขึ้นมาใหม่ และดังนั้น จึงปรากฏชัดเจนน้อยกว่าถ้ามีโฟเลตมาก ตั้งแต่ปลายคริสต์ทศวรรษ 1990 ประเทศต่าง ๆ เริ่มเสริมโฟเลตในแป้ง ดังนั้นการขาดโฟเลตในปัจจุบันจึงน้อยลง และในเวลาเดียวกัน เนื่องจากการตรวจภาวะเลือดจาง และขนาดเม็ดเลือดแดง ที่ไวต่อปัญหาการสังเคราะห์ดีเอ็นเอ เดี๋ยวนี้ทำเป็นปกติแม้แต่ในการทดสอบทางคลินิกทั่วไป (และดังนั้น ผลทางชีวเคมีของโฟเลตบ่อยครั้งสามารถตรวจเจอได้โดยตรง)
ผลของการขาดวิตามินบี12 ในกระบวนการ MTR จึงอาจไม่ปรากฏเป็นภาวะเลือดจางเหตุการสังเคราะห์ดีเอ็นเอตามที่เคยพบมาก่อน แต่ปรากฏเป็นระดับ homocysteine ที่สูงขึ้นในเลือดและในปัสสาวะ (homocysteinuria) ซึ่งชัดเจนน้อยกว่า แต่ภาวะนี้อาจมีผลเสียหายในระยะยาวต่อเส้นเลือดและการจับลิ่ม (มีผลเป็นโรคหลอดเลือดสมองและโรคหัวใจ) และผลเช่นนี้ยากที่จะจำแนกจากกระบวนการทั่วไปที่สัมพันธ์กับโรคหลอดเลือดแดงแข็งและการสูงอายุขึ้น
ความเสียหายต่อปลอกไมอีลินเหตุขาดวิตามินบี12 แม้จะมีโฟเลตและ methionine เพียงพอ เป็นตัวแสดงการขาดวิตามินที่ชัดเจนโดยเฉพาะ ซึ่งสัมพันธ์กับปฏิกิริยาของวิตามินในกระบวนการ MUT ซึ่งจำเป็นอย่างขาดไม่ได้ในการเปลี่ยน methylmalonyl coenzyme A เป็น succinyl coenzyme A ความล้มเหลวของกระบวนการหลังนี้มีผลเป็นระดับที่สูงขึ้นของ methylmalonic acid (MMA) ซึ่งเป็นตัวทำปลอกไมอีลินให้เสียหาย คือ การมี MMA จะขัดขวางการสังเคราะห์กรดไขมันตามปกติ หรือว่าตัวกรดเองอาจรวมเข้ากับกรดไขมันแทนที่ malonic acid ตามปกติ และถ้ากรดไขมันที่ผิดปกตินี้กลายเป็นส่วนประกอบของปลอกไมอีลิน ปลอกก็จะเปราะ และหลุดออก (demyelination) แม้ว่ารายละเอียดของกลไกนี้ยังไม่ชัดเจนนัก แต่ผลก็คือระบบประสาทกลางหรือไขสันหลังเสื่อมแบบรวมกึ่งเฉียบพลัน (subacute combined degeneration)[68] และไม่ว่าเหตุจะคืออะไร แต่รู้อยู่แล้วว่าการขาดวิตามินบี12 มีผลเป็นโรคเส้นประสาท (neuropathies) แม้ว่า จะมีโฟเลตเพียงพอ และดังนั้น จะไม่ปรากฏภาวะเลือดจาง
กระบวนการ MTR ที่อาศัยวิตามินบี12 ก็อาจทำให้เกิดผลทางประสาทเช่นกัน แม้ว่าจะโดยอ้อม เพราะว่า การมี methionine ที่เพียงพอ (และเหมือนกับโฟเลต ถ้าไม่ได้จากอาหาร ก็จะต้องสร้างใหม่จาก homocysteine ในปฏิกิริยาที่อาศัยวิตามิน) จำเป็นเพื่อจะสร้าง S-adenosyl-methionine (SAMe) ซึ่งจำเป็นในการสร้างฟอสโฟลิพิดของปลอกไมอีลิน แม้ว่าการผลิต SAMe จะไม่อาศัยวิตามิน แต่ว่า วิตามินก็ยังเป็นตัวช่วยเพื่อแปรซับสเตรตที่จำเป็น คือ methionine ให้สามารถนำไปใช้ใหม่ นอกจากนั้แล้ว SAMe ยังมีบทบาทในการผลิตสารสื่อประสาทและ catecholamines (ซึ่งเป็นส่วนประกอบของสารสื่อประสาท) บางอย่าง และเมแทบอลิซึมในสมอง สารสื่อประสาทเหล่านี้สำคัญในการดำรงอารมณ์ ซึ่งอาจอธิบายว่าทำไมโรคซึมเศร้าจึงสัมพันธ์กับการขาดวิตามินบี12 แต่ว่า การสร้างฟอสโฟลิพิดของปลอกไมอีลินก็ขึ้นอยู่กับการมีโฟเลตพอด้วย ซึ่งจะขึ้นอยู่กับกระบวนการ MTR ยกเว้นถ้าทานจากอาหารมากพอ
การดูดซึมและการส่งต่อ
แก้Methyl-B12 สามารถดูดซึมได้ผ่านกระบวนการสองอย่าง อย่างแรกเป็นการดูดซึมผ่านลำไส้โดยใช้ intrinsic factor ซึ่งสามารถดูดซึมได้ 1–2 ไมโครกรัมทุก ๆ 2–3 ชม. อย่างที่สองเป็นการแพร่ ซึ่งดูดซึมวิตามิน 1% ที่เหลือ[69] แต่กระบวนการทางสรีรภาพของมนุษย์เกี่ยวกับวิตามินบี12 เป็นเรื่องซับซ้อน และดังนั้น จึงง่ายที่จะมีปัญหาทำให้ขาดวิตามินบี12 เช่น วิตามินที่ยึดอยู่กับโปรตีนต้องย่อยออกจากโปรตีนก่อนโดยฤทธิ์ของเอนไซม์ protease ที่เป็นตัวย่อยทั้งในกระเพาะอาหารและในลำไส้เล็ก[70] ส่วนกรดกระเพาะอาหารเป็นตัวย่อยวิตามินออกจากตัวอาหาร ดังนั้น ยา antacid หรือขัดขวางการหลั่งกรด (โดยเฉพาะยายับยั้งการหลั่งกรด) อาจจะขัดขวางการดูดซึมวิตามินบี12 นอกจากนั้นแล้ว บางคนยังหลั่งกรดน้อยลงเมื่อสูงอายุขึ้น ซึ่งเพิ่มโอกาสขาดวิตามินด้วย[71]
วิตามินบี12 เสริมแบบที่ละลายน้ำได้น้อย เคี้ยวไม่ได้ อาจจะดำเนินผ่านปากและกระเพาะโดยไม่ผสมกับกรดกระเพาะอาหารเลย แต่ว่า กรดก็ไม่จำเป็นเพื่อดูดซึมวิตามินที่ไม่ยึดกับโปรตีน ดังนั้น กรดจึงจำเป็นเพื่อจะได้วิตามินบี12 เพียงจากอาหารธรรมชาติ R-protein หรือที่เรียกว่า haptocorrin และ cobalophilin เป็นโปรตีนยึดวิตามินบี12 ที่ผลิตโดยต่อมน้ำลาย แต่มันจะต้องรอวิตามินย่อยออกจากโปรตีนในอาหารโดยเอนไซม์เพพซินในกระเพาะอาหารก่อน จากนั้น วิตามินก็จะยึดกับ R-protein เพื่อไม่ให้เสื่อมเพราะกรดในกระเพาะ[72]
รูปแบบที่วิตามินบี12 ต้องยึดกับโปรตีนที่หลั่งออกในขั้นตอนการย่อยก่อน ๆ ก็จะเกิดซ้ำอีกครั้งก่อนจะดูดซึมเข้าร่างกาย โปรตีนที่จะยึดวิตามินบี12 ต่อไปก็คือ intrinsic factor (IF) ซึ่งเซลล์ผนัง (parietal cell) ของกระเพาะอาหารหลั่งออกตอบสนองต่อฮิสตามีน, gastrin, pentagastrin และ ต่อพร้อมทั้งอาหารด้วย ในลำไส้เล็กส่วนต้น เอนไซม์ protease จะย่อยบี12 ออกจาก R-protein และบี12 ก็จะเข้ายึดกับ IF กลายเป็นสารประกอบ IF/B12 บี12 จำเป็นต้องยึดกับ IF ถ้าจะดูดซึมได้อย่างมีประสิทธิภาพ เพราะว่า ตัวรับของเซลล์ enterocyte ในลำไส้เล็กส่วนปลาย (terminal ileum) รู้จักแต่สารประกอบ B12-IF นอกจากนั้นแล้ว intrinsic factor ยังป้องกันวิตามินจากกระบวนการแคแทบอลิซึมโดยแบคทีเรียในลำไส้
ดังนั้น การดูดซึมวิตามินบี12 จำเป็นต้องมีกระเพาะอาหาร, ตับอ่อน (ส่วนที่มีหน้าที่เกี่ยวกับการย่อยอาหาร), intrinsic factor (IF), และลำไส้เล็กที่ทำงานได้ ปัญหาต่ออวัยวะใดอวัยวะหนึ่งสามารถทำให้ขาดวิตามินบี12 ได้ บุคคลที่ไม่มี IF จะสามารถดูดซึมวิตามินได้น้อยลง
ในโรค pernicious anemia คนไข้ไม่มี IF เนื่องจากกระเพาะอาหารอักเสบเรื้อรังแบบฝ่อเหตุภูมิต้านตนเอง (autoimmune atrophic gastritis) ที่สารภูมิต้านทาน (antibodies) เข้าทำลายเซลล์ผนัง หรืออาจจะเข้ายึดกับ IF เอง ซึ่งขัดขวางไม่ให้ IF ทำงานป้องกันบี12
เนื่องจากความซับซ้อนในการดูดซึมวิตามิน คนไข้สูงอายุ ซึ่งหลายคนจะมีกรดในกระเพาะอาหารน้อยลงเนื่องจากการทำงานของเซลล์ผนังที่ลดลง มีโอกาสเสี่ยงขาดวิตามินบี12 สูงขึ้น[73] ซึ่งทำให้ขับออกทางอุจจาระ 80–100% ของวิตามินที่ทาน เทียบกับ 30–60% ในบุคคลที่มี IF ปกติ[73]
เมื่อตัวรับในลำไส้เล็กรู้จำสารประกอบ IF/B12 ได้ ก็จะช่วยขนส่งมันเข้าไปในระบบเลือด hepatic portal system ซึ่งวิตามินจะย้ายไปอยู่กับ transcobalamin II (TC-II/B12) ซึ่งทำหน้าที่เป็นตัวขนส่งวิตามินในเลือด ปัญหาทางกรรมพันธุ์ในการผลิต transcobalamins และตัวรับของมัน อาจทำให้ขาดวิตามิน, ภาวะเลือดจางแบบเม็ดเลือดโต (megaloblastic anemia), และความผิดปกติทางชีวเคมีที่เกี่ยวกับกับวิตามินบี12 ต่าง ๆ แม้ว่าอาจจะมีระดับวิตามินในเลือดที่ปกติ เพื่อที่วิตามินจะเข้าไปในเซลล์ สารประกอบ TC-II/B12 จะต้องเข้ายึดกับตัวรับของเซลล์แล้วผ่านกระบวนการนำสารเข้าสู่เซลล์ (endocytosis) โดย transcobalamin-II จะเสื่อมลงในไลโซโซมของเซลล์แล้วปล่อยบี12 ออกเข้าไปในไซโทพลาซึม ซึ่งวิตามินจะเปลี่ยนเป็น coenzyme ที่ใช้ได้ โดยอาศัยเอนไซม์ภายในเซลล์อื่น ๆ (ดังที่กล่าวมาแล้ว)
งานศึกษาที่ตรวจสอบการดูดซึมวิตามินบี12 ในลำไส้ชี้ว่า ระดับการดูดซึมสูงสุดสำหรับการทานแต่ละครั้งเมื่อสถานการณ์อื่นปกติ อยู่ที่ประมาณ 1.5 µg "งานศึกษาในบุคคลปกติชี้ว่า ร่างกายจะดูดซึมประมาณ 1.5 µg ของการทานครั้งหนึ่งที่ทานเข้าไป 5–50 µg ในงานศึกษาที่คล้ายกันของ Swendseid et al อ้างว่า ระดับเฉลี่ยการดูดซึมสูงสุดอยู่ที่ 1.6 µg [...]"[74]
แต่กระบวนการดูดซึมแบบแพร่ของวิตามินบี12 ดังที่กล่าวแล้ว สามารถมีมากกว่าการดูดซึมที่ต้องอาศัย R-protein และ IF เมื่อวิตามินที่ทานมีปริมาณมาก (1,000 µg หรือมากกว่านั้น) ซึ่งมักจะเกิดขึ้นในยาเสริมวิตามินที่มีแต่บี12 อย่างเดียว เป็นกระบวนการสุดท้ายนี่แหละที่ทำให้สามารถรักษา pernicious anemia และปัญหาการดูดซึมวิตามินบี12 ด้วยการให้วิตามินเสริมปริมาณมหาศาล โดยที่ไม่ต้องแก้ปัญหาการดูดซึมโดยตรง[75]
วิตามินบี12 ที่สะสมในร่างกายผู้ใหญ่มีประมาณ 2–5 มก. ประมาณ 50% อยู่ในตับ แต่จะเสียไปประมาณ 0.1% ทุกวันโดยหลั่งออกในลำไส้ และวิตามินในลำไส้ไม่ได้รับการดูดซึมทั้งหมด แม้ว่า น้ำดีจะเป็นตัวหลั่งวิตามินหลัก แต่วิตามินบี12 ในน้ำดีก็สามารถนำไปใช้ใหม่ผ่านกระบวนการ enterohepatic circulation (การดูดซึมโดย Enterocyte ในลำไส้เล็กแล้วส่งไปที่ตับ) เนื่องจากประสิทธิภาพของกระบวนการนี้ ตับสามารถสะสมวิตามินบี12 ที่ใช้ได้นาน 3–5 ปี ภายใต้สภาวะและการทำงานที่ปกติ[76][77] ดังนั้น การขาดวิตามินนี้จึงค่อนข้างมีน้อย
แต่ว่า อัตราการเปลี่ยนแปลงของระดับวิตามินบี12 อาจเปลี่ยนไปโดยขึ้นอยู่กับปัจจัยหลายอย่างรวมทั้งการได้จากอาหาร ปริมาณที่หลั่งออก และจำนวนที่ดูดซึมได้ การขาดวิตามินอาจเกิดขึ้นภายในปีหนึ่งถ้ามีน้อยอยู่แล้วและปัจจัยทางกรรมพันธุ์ไม่เอื้ออำนวย หรืออาจไม่เกิดเป็นทศวรรษ ๆ แต่ว่าในทารก การขาดวิตามินจะปรากฏเร็วกว่ามาก[78]
ประวัติ
แก้การขาดวิตามินบี12 เป็นเหตุของ pernicious anemia ซึ่งเป็นภาวะเลือดจางที่ปกติถึงชีวิตและเป็นโรคที่ไม่รู้สมุฏฐานเมื่อพบเป็นครั้งแรก วิธีการรักษาและการค้นพบวิตามินบี12 เป็นเรื่องบังเอิญ นพ. จอร์จ วิปเปิ้ล ได้ทดลองสร้างภาวะเลือดจางในสุนัขโดยเอาเลือดมันออก แล้วเลี้ยงมันด้วยอาหารต่าง ๆ เพื่อสังเกตว่าอะไรทำให้ฟื้นตัวจากภาวะเลือดจางได้เร็วที่สุด โดยวิธีนี้ เขาพบว่าการกินตับเป็นจำนวนมากดูเหมือนจะช่วยรักษาภาวะเลือดจางเนื่องจากเสียเลือดได้เร็วที่สุด ดังนั้น เขาจึงตั้งสมมติฐานว่า การทานตับอาจช่วยรักษา pernicious anemia เขาลองสมมติฐานนี้แล้วรายงานความสำเร็จในระดับหนึ่งในปี 2463
หลังจากการศึกษาทางคลินิกหลายงาน นพ. จอร์จ ไมนอต และ นพ. วิลเลียม เมอร์ฟี่ พยายามแยกสารในตับที่ช่วยรักษาภาวะเลือดจางในสุนัขแล้วพบว่ามันคือธาตุเหล็ก แต่ก็พบสารอีกอย่างหนึ่งในตับที่รักษา pernicious anemia ในมนุษย์ แต่ไม่มีผลต่อสุนัขภายใต้ภาวะของการทดลอง ดังนั้น ยาที่ใช้รักษา pernicious anemia ซึ่งพบในตับ จึงได้ค้นพบโดยบังเอิญเช่นนี้ นพ. ทั้งสองรายงานการทดลองเหล่านี้ในปี 2469 ซึ่งเป็นความก้าวหน้าแรก ๆ ในการรักษาโรคนี้ แม้จะได้ค้นพบเช่นนี้ ยังเป็นเวลาอีกหลายปีที่คนไข้ยังต้องทานตับดิบหรือดื่มน้ำตับเป็นจำนวนมาก ต่อมาปี 2471 นักเคมี ดร. เอ็ดวิน โคห์น สกัดสารจากตับที่มีฤทธิ์ 50–100 เท่ามากกว่าตับธรรมชาติ ซึ่งเป็นวิธีการรักษาโรคที่ใช้ได้จริง ๆ สำหรับผลงานเบื้องต้นที่ชี้แนวทางการรักษา นพ. ไมนอต และเมอร์ฟี่ ต่อมาจึงได้รับรางวัลโนเบลสาขาสรีรวิทยาหรือการแพทย์ปี 2477 ร่วมกัน เหตุการณ์เหล่านี้ต่อมาทำให้ค้นพบวิตามินที่ละลายน้ำได้ ซึ่งเรียกว่าวิตามินบี12 จากซุปแบคทีเรีย
ในปี 2490 เมื่อทำงานอยู่ในมหาวิทยาลัยแมรี่แลนด์ ดร. แมรี่ ชอว์ ชอร์บ ในงานที่ทำร่วมกับ ดร. คาร์ล โฟลเกอร์ส แห่งบริษัทเมอร์ค ได้รับเงินทุนเพื่อพัฒนาแบบทดสอบ "LLD assay" เพื่อวิตามินบี12 โดย LLD หมายถึง Lactobacillus lactis Dorner[79] ซึ่งเป็นแบคทีเรียที่จำต้องได้สารที่เรียกว่า "LLD factor" เพื่อการเติบโต ซึ่งต่อมาระบุว่าเป็นวิตามินบี12 ดร. ชอร์บและเพื่อนร่วมงานได้ใช้ LLD assay เพื่อสกัดยาต้าน pernicious anemia จากตับ และในปี 2491 จึงสามารถสกัดวิตามินบริสุทธิ์ได้โดยได้รับการร่วมมือจาก ดร. ชอร์บ[80] ดร. คาร์ล โฟลเกอร์ส และอเล็กซานเดอร์ ทอดด์แห่งประเทศอังกฤษ เพื่อการค้นนี้ ในปี 2492 ดร. ชอร์บ และ ดร. โฟลเกอร์ส ได้รับรางวัล Mead Johnson Award จาก American Society of Nutritional Sciences[80]
ดร. โดโรธี โครว์ฟุต ฮอดจ์คิน และทีมเป็นผู้กำหนดโครงสร้างทางเคมีของวิตามินในปี 2499 โดยอาศัยข้อมูลทางผลิกศาสตร์[81] ในที่สุด วิธีการผลิตวิตามินเป็นจำนวนมากจากแบคทีเรียก็พัฒนาขึ้นในช่วงคริสต์ทศวรรษ 1950 ซึ่งทำให้เกิดการรักษาโรคดังที่ทำในปัจจุบัน
เชิงอรรถและอ้างอิง
แก้- ↑ Yamada, Kazuhiro (2013). "Chapter 9. Cobalt: Its Role in Health and Disease". ใน Sigel, Astrid; Sigel, Helmut; Sigel, Roland KO (บ.ก.). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. Vol. 13. Springer. pp. 295–320. doi:10.1007/978-94-007-7500-8_9.
- ↑ 2.0 2.1 2.2 2.3 2.4 "Dietary Supplement Fact Sheet: Vitamin B12". Office of Dietary Supplements, National Institutes of Health. สืบค้นเมื่อ 2011-09-28.
- ↑ 3.0 3.1 "Vitamin B12". The American Society of Health-System Pharmacists. สืบค้นเมื่อ 2011-04-03.
- ↑ Hall, AH; Rumack, BH (1987). "Hydroxycobalamin/sodium thiosulfate as a cyanide antidote". The Journal of Emergency Medicine. 5 (2): 115–21. doi:10.1016/0736-4679(87)90074-6. PMID 3295013.
- ↑ Dart, RC (2006). "Hydroxocobalamin for acute cyanide poisoning: new data from preclinical and clinical studies; new results from the prehospital emergency setting". Clinical Toxicology. 44 (Suppl 1): 1–3. doi:10.1080/15563650600811607. PMID 16990188.
- ↑ "Tolerable Upper Intake Levels For Vitamins And Minerals" (PDF). European Food Safety Authority. 2006.
- ↑ Institute of Medicine (1998). "Vitamin B12". Dietary Reference Intakes for Thiamin, Riboflavin, Niacin, Vitamin B6, Folate, Vitamin B12, Pantothenic Acid, Biotin, and Choline. Washington, DC: The National Academies Press. pp. 340–342. ISBN 0-309-06554-2. สืบค้นเมื่อ 2012-02-07.
- ↑ Walsh, Stephen. "What every vegan should know about vitamin B12". Vegan Society. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2007-07-17. สืบค้นเมื่อ 2007-12-03.
- ↑ 9.0 9.1 Mangels, Reed. "Vitamin B12 in the Vegan Diet". Vegetarian Resource Group. สืบค้นเมื่อ 2008-01-17.
- ↑ 10.0 10.1 "Don't Vegetarians Have Trouble Getting Enough Vitamin B12?". Physicians Committee for Responsible Medicine. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2007-02-17. สืบค้นเมื่อ 2008-01-17.
- ↑ Albert, M. J.; Mathan, V. I.; Baker, S. J. (1980). "Vitamin B12 synthesis by human small intestinal bacteria". Nature. 283 (5749): 781–782. doi:10.1038/283781a0. PMID 7354869.
- ↑ Kelly, R. J.; Gruner, T. M.; Furlong, J. M.; Sykes, A. R. (2006). "Analysis of corrinoids in ovine tissues". Biomedical Chromatography. 20 (8): 806–814. doi:10.1002/bmc.604. PMID 16345011.
- ↑ Yamada, K.; Shimodaira, M.; Chida, S.; Yamada, N.; Matsushima, N.; Fukuda, M.; Yamada, S. (2008). "Degradation of Vitamin B12 in Dietary Supplements". International Journal for Vitamin and Nutrition Research. 78 (45): 195–203. doi:10.1024/0300-9831.78.45.195. PMID 19326342.
- ↑ 14.0 14.1 Watanabe, F.; Katsura, H.; Takenaka, S.; Fujita, T.; Abe, K.; Tamura, Y.; Nakatsuka, T.; Nakano, Y. (1999). "Pseudovitamin B(12) is the predominant cobamide of an algal health food, spirulina tablets". Journal of Agricultural and Food Chemistry. 47 (11): 4736–4741. doi:10.1021/jf990541b. PMID 10552882.
- ↑ Kittaka-Katsura, H.; Fujita, T.; Watanabe, F.; Nakano, Y. (2002). "Purification and characterization of a corrinoid compound from Chlorella tablets as an algal health food". Journal of Agricultural and Food Chemistry. 50 (17): 4994–4997. doi:10.1021/jf020345w. PMID 12166996.
- ↑ van der Put, Nathalie M. J.; van Straaten, Henny W. M.; Trijbels, Frans J. M.; Blom, Henk J. (2001-04-01). "Folate, Homocysteine and Neural Tube Defects: An Overview". Experimental Biology and Medicine (ภาษาอังกฤษ). 226 (4): 243–270. ISSN 1535-3702. PMID 11368417. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2020-03-13. สืบค้นเมื่อ 2016-12-18.
- ↑ Sethi, NK; Robilotti, E; Sadan, Y (2005). "Neurological Manifestations Of Vitamin B-12 Deficiency". The Internet Journal of Nutrition and Wellness. 2 (1). doi:10.5580/5a9. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2013-10-20. สืบค้นเมื่อ 2016-12-18.
- ↑ Masalha, R; Chudakov, B; Muhamad, M; Rudoy, I; Volkov, I; Wirguin, I (2001). "Cobalamin-responsive psychosis as the sole manifestation of vitamin B12 deficiency". Israeli Medical Association Journal. 3: 701–703. PMID 11574992.
- ↑ Killen, J. P.; Brenninger, V. L. (2013). "Vitamin B12 deficiency". N. Engl. J. Med. 368: 2040–1. doi:10.1056/nejmc1304350.
- ↑ Sangle P; Sandhu O; Aftab Z; และคณะ (2020-10-26). "Vitamin B12 Supplementation: Preventing Onset and Improving Prognosis of Depression". Cureus. 12 (10): e11169. doi:10.7759/cureus.11169.
- ↑ Biemans, E.; Hart, H.E.; Rutten, G.E.; Renteria, V.G.C.; Kooijman-Buiting, A.M.; Beulens, J.W. (October 2014). "Cobalamin status and its relation with depression, cognition and neuropathy in patients with type 2 diabetes mellitus using metformin". Acta Diabetologica: 1–11. doi:10.1007/s00592-014-0661-4.
- ↑ Bottiglieri, T.; Laundy, M.; Crellin, R.; Toone, B.K.; Carney, M.W.; Reynolds, E.H. (2000). "Homocysteine, folate, methylation, and monoamine metabolism in depression". Journal of Neurology, Neurosurgery & Psychiatry. 69 (2): 228–232. doi:10.1136/jnnp.69.2.228.
- ↑ Herrmann, Wolfgang; Obeid, Rima (2008-10-03). "Causes and Early Diagnosis of Vitamin B12 Deficiency". Deutsches Ärzteblatt international. doi:10.3238/arztebl.2008.0680. ISSN 1866-0452. PMC 2696961. PMID 19623286.
{{cite journal}}: CS1 maint: PMC format (ลิงก์) - ↑ Sloan, Jennifer L.; Johnston, Jennifer J.; Manoli, Irini; Chandler, Randy J.; Krause, Caitlin; Carrillo-Carrasco, Nuria; Chandrasekaran, Suma D.; Sysol, Justin R.; O'Brien, Kevin; Hauser, Natalie S.; Sapp, Julie C. (2011). "Exome sequencing identifies ACSF3 as a cause of combined malonic and methylmalonic aciduria". Nature Genetics (ภาษาอังกฤษ). 43 (9): 883–886. doi:10.1038/ng.908. ISSN 1546-1718. PMC 3163731. PMID 21841779.
{{cite journal}}: CS1 maint: PMC format (ลิงก์) - ↑ de Sain-van der Velden, Monique G. M.; van der Ham, Maria; Jans, Judith J.; Visser, Gepke; Prinsen, Hubertus C. M. T.; Verhoeven-Duif, Nanda M.; van Gassen, Koen L. I.; van Hasselt, Peter M. (2016), Morava, Eva; Baumgartner, Matthias; Patterson, Marc; Rahman, Shamima (บ.ก.), "A New Approach for Fast Metabolic Diagnostics in CMAMMA", JIMD Reports, Volume 30 (ภาษาอังกฤษ), Springer, pp. 15–22, doi:10.1007/8904_2016_531, ISBN 978-3-662-53681-0, PMC 5110436, PMID 26915364
{{citation}}: CS1 maint: PMC format (ลิงก์) - ↑ Watanabe, F (2007). "Vitamin B12 sources and bioavailability". Exp. Biol. Med. (Maywood). 232 (10): 1266–74. doi:10.3181/0703-MR-67. PMID 17959839.
- ↑ "อาหารหมักดอง ของแสลงจริงหรือ". ชีวจิต. Vol. 146. 1 พฤศจิกายน 2547. ISSN 1513-086X.
- ↑ Walsh, Stephen, RD. "Vegan Society B12factsheet". Vegan Society. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2008-05-26. สืบค้นเมื่อ 2008-01-17.
- ↑ Sharabi, A; Cohen, E; Sulkes, J; Garty, M (2003). "Replacement therapy for vitamin B12 deficiency: comparison between the sublingual and oral route". British Journal of Clinical Pharmacology. 56 (6): 635–8. doi:10.1046/j.1365-2125.2003.01907.x. PMC 1884303. PMID 14616423.
- ↑ Bolaman, Z; Kadikoylu, G; Yukselen, V; Yavasoglu, I; Barutca, S; Senturk, T (2003). "Oral versus intramuscular cobalamin treatment in megaloblastic anemia: a single-center, prospective, randomized, open-label study". Clin Ther. 25 (12): 3124–34. doi:10.1016/S0149-2918(03)90096-8. PMID 14749150.
- ↑ Lane, LA; Rojas-Fernandez, C (2002). "Treatment of vitamin b(12) -deficiency anemia: oral versus parenteral therapy". Ann Pharmacother. 36 (7–8): 1268–72. doi:10.1345/aph.1A122. PMID 12086562.
- ↑ Butler, C. C. (2006). "Oral vitamin B12 versus intramuscular vitamin B12 for vitamin B12 deficiency: A systematic review of randomized controlled trials". Family Practice. 23 (3): 279–285. doi:10.1093/fampra/cml008. PMID 16585128.
- ↑ Andersson, HC; Shapira, E (1998). "Biochemical and clinical response to hydroxocobalamin versus cyanocobalamin treatment in patients with methylmalonic acidemia and homocystinuria (cblC)". J. Pediatr. 132 (1): 121–4. doi:10.1016/S0022-3476(98)70496-2. PMID 9470012.
- ↑ Roze, E; Gervais, D; Demeret, S; และคณะ (2003). "Neuropsychiatric disturbances in presumed late-onset cobalamin C disease". Arch. Neurol. 60 (10): 1457–62. doi:10.1001/archneur.60.10.1457. PMID 14568819.
- ↑ Thauvin-Robinet, C; Roze, E; Couvreur, G; และคณะ (2008). "The adolescent and adult form of cobalamin C disease: clinical and molecular spectrum". J. Neurol. Neurosurg. Psychiatr. 79 (6): 725–8. doi:10.1136/jnnp.2007.133025. PMID 18245139.
- ↑ Heil, SG; Hogeveen, M; Kluijtmans, LA; และคณะ (2007). "Marfanoid features in a child with combined methylmalonic aciduria and homocystinuria (CblC type)". J. Inherit. Metab. Dis. 30 (5): 811. doi:10.1007/s10545-007-0546-6. PMID 17768669.
- ↑ Tsai, A. C. H.; Morel, C. F.; Scharer, G.; Yang, M.; Lerner-Ellis, J. P.; Rosenblatt, D. S.; Thomas, J. A. (2007). "Late-onset combined homocystinuria and methylmalonic aciduria (cblC) and neuropsychiatric disturbance". American Journal of Medical Genetics Part A. 143A (20): 2430–2434. doi:10.1002/ajmg.a.31932. PMID 17853453.
- ↑ 38.0 38.1 Aguilar, F; Charrondiere, U; และคณะ (2008-09-25). "5'-deoxyadenosylcobalamin and methylcobalamin as sources for Vitamin B12 added as a nutritional substance in food supplements: Scientific opinion of the Scientific Panel on Food Additives and Nutrient Sources added to food". EFSA Journal. 815: 1–21. doi:10.2903/j.efsa.2008.815. "the metabolic fate and biological distribution of methylcobalamin and 5’-deoxyadenosylcobalamin are expected to be similar to that of other sources of vitamin B12 in the diet."
- ↑ Kwak, C. S.; Lee, M. S.; Lee, H. J.; Whang, J. Y.; Park, S. C. (2010). "Dietary source of vitamin B12 intake and vitamin B12 status in female elderly Koreans aged 85 and older living in rural area". Nutrition Research and Practice. 4 (3): 229–234. doi:10.4162/nrp.2010.4.3.229. PMC 2895704. PMID 20607069.
- ↑ Kwak, C. S.; Lee, M. S.; Oh, S. I.; Park, S. C. (2010). "Discovery of Novel Sources of Vitamin B12 in Traditional Korean Foods from Nutritional Surveys of Centenarians". Current Gerontology and Geriatrics Research. 2010: 1–11. doi:10.1155/2010/374897. PMC 3062981. PMID 21436999.
- ↑ Yamada, K.; Yamada, Y.; Fukuda, M.; Yamada, S. (1999). "Bioavailability of dried asakusanori (porphyra tenera) as a source of Cobalamin (Vitamin B12)". International journal for vitamin and nutrition research. Internationale Zeitschrift fur Vitamin- und Ernahrungsforschung. Journal international de vitaminologie et de nutrition. 69 (6): 412–418. doi:10.1024/0300-9831.69.6.412. PMID 10642899.
- ↑ Fiona M Callaghan; Kira Leishear; Swapna Abhyankar; Dina Demner-Fushman; Clement J McDonald (2014-04-01). "High vitamin B12 levels are not associated with increased mortality risk for ICU patients after adjusting for liver function: a cohort study". ESPEN J. 9 (2): e76–e83. doi:10.1016/j.clnme.2014.01.003. PMID 24665415.
[e]levated B12 levels are not a significant predictor of mortality after ICU admission when liver function is controlled for, and may instead be a proxy for poor liver function.
- ↑ Arendt, JF; Nexo, E (2013-03-01). "Unexpected high plasma cobalamin: proposal for a diagnostic strategy". Clinical Chemistry and Laboratory Medicine. 51 (3): 489–96. doi:10.1515/cclm-2012-0545. PMID 23241600.
- ↑ Johan Frederik; Berg Arendt; Lars Pedersen; Ebba Nexo; Henrik Toft Sørensen (2013-12-04). "Elevated Plasma Vitamin B12 Levels as a Marker for Cancer: A Population-Based Cohort Study". Journal of the National Cancer Institute. 105 (23): 1799–805. doi:10.1093/jnci/djt315. PMID 24249744.
Elevated plasma vitamin B12 levels as a marker for cancer: a population-based cohort study
. published 2013-11-18. - ↑ Ermens, AA; Vlasveld, LT; Lindemans, J (November 2003). "Significance of elevated cobalamin (vitamin B12) levels in blood". Clinical Biochemistry. 36 (8): 585–90. PMID 14636871.
Altogether it can be concluded that an observed elevation of cobalamin in blood merits a full diagnostic work up to assess the presence of disease
- ↑ De Jager, J.; Kooy, A.; Lehert, P.; Wulffelé, M. G.; Van Der Kolk, J.; Bets, D.; Verburg, J.; Donker, A. J. M.; Stehouwer, C. D. A. (2010). "Long term treatment with metformin in patients with type 2 diabetes and risk of vitamin B-12 deficiency: Randomised placebo controlled trial". BMJ. 340: c2181. doi:10.1136/bmj.c2181. PMC 2874129. PMID 20488910.
an independent risk factor for cardiovascular disease, especially among individuals with type 2 diabetes
- ↑ Andrès, E; Noel, E; Goichot, B (2002). "Metformin-associated vitamin B12 deficiency". Arch Intern Med. 162 (19): 2251–2. doi:10.1001/archinte.162.19.2251-a. PMID 12390080.
- ↑ Gilligan, M (2002). "Metformin and vitamin B12 deficiency". Arch Intern Med. 162 (4): 484–5. doi:10.1001/archinte.162.4.484. PMID 11863489.
- ↑ Bauman, WA; Shaw, S; Jayatilleke, E; Spungen, AM; Herbert, V (2000). "Increased intake of calcium reverses vitamin B12 malabsorption induced by metformin". Diabetes Care. 23 (9): 1227–31. doi:10.2337/diacare.23.9.1227. PMID 10977010.
- ↑ Copp, Samantha (2007-12-01). "What effect does metformin have on vitamin B12 levels?". UK Medicines Information, NHS. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2007-09-27.
- ↑ Jaouen G, บ.ก. (2006). Bioorganometallics: Biomolecules, Labeling, Medicine. Weinheim: Wiley-VCH. pp. 17–25. ISBN 978-3-527-30990-0.
- ↑ Loeffler, G. (2005). Basiswissen Biochemie. Heidelberg: Springer. p. 606. ISBN 3-540-23885-9.
- ↑ Bertrand, EM; Saito, MA; Young, JJ; Neilan, BA (2011). "Vitamin B12 biosynthesis gene diversity in the Ross Sea: the identification of a new group of putative polar B12 biosynthes". Environmental Microbiology. 13 (5): 1285–98. doi:10.1111/j.1462-2920.2011.02428.x. PMID 21410623.
- ↑ Khan, Adil Ghani; Eswaran, S. V. (2003). "Woodward's synthesis of vitamin B12". Resonance. 8 (6): 8–16. doi:10.1007/BF02837864.
- ↑ Eschenmoser, A; Wintner, CE (June 1977). "Natural product synthesis and vitamin B12". Science. 196 (4297): 1410–20. doi:10.1126/science.867037. PMID 867037.
- ↑ Riether, Doris; Mulzer, Johann (2003). "Total Synthesis of Cobyric Acid: Historical Development and Recent Synthetic Innovations". European Journal of Organic Chemistry. 2003: 30–45. doi:10.1002/1099-0690(200301)2003:1<30::AID-EJOC30>3.0.CO;2-I.
- ↑ Martens, JH; Barg, H; Warren, MJ; Jahn, D (2002). "Microbial production of vitamin B12". Applied Microbiology and Biotechnology. 58 (3): 275–85. doi:10.1007/s00253-001-0902-7. PMID 11935176.
- ↑ Linnell, JC; Matthews, DM (1984). "Cobalamin metabolism and its clinical aspects". Clinical Science. 66 (2): 113–21. PMID 6420106.
- ↑ Vitamin B12. Code of Federal Regulations. U.S. Government Printing Office. Title 21, Volume 3. Revised. April 1, 2001. CITE: 21CFR184.1945 p. 552
- ↑ De Baets, S; Vandedrinck, S; Vandamme, EJ (2000). "Vitamins and Related Biofactors, Microbial Production". ใน Lederberg, J (บ.ก.). Encyclopedia of Microbiology. Vol. 4 (2nd ed.). New York: Academic Press. pp. 837–853. ISBN 0-12-226800-8.
- ↑ Thibaut, D; Blanche, F; Cameron, B; Crouzet, J; Debussche, L; Remy, E; Vuilhorgne, M (1998-02-12). "Vitamin B12 biosynthesis in Pseudomonas aeruginosa". ใน Kräutler, B; Arigoni, D; Golding, BT (บ.ก.). Vitamin B12 and B12‐Proteins. Weinheim, Germany: Wiley/VCH. pp. 63–79. doi:10.1002/9783527612192. ISBN 9783527612192.
- ↑ Riaz, Muhammad; Iqbal, Fouzia; Akram, Muhammad (2007). "Microbial production of vitamin B12 by methanol utilizing strain of Pseudomonas specie". Pak J. Biochem. Mol. Biol. 1. 40: 5–10.
- ↑ Yemei, Zhang (2009-01-26). "New round of price slashing in vitamin B12 sector. (Fine and Specialty)". China Chemical Reporter. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2013-05-13. สืบค้นเมื่อ 2016-12-18.
- ↑ Voet, Judith G.; Voet, Donald (1995). Biochemistry. New York: J. Wiley & Sons. p. 675. ISBN 0-471-58651-X. OCLC 31819701.
- ↑ Banerjee, R; Ragsdale, SW (2003). "The many faces of vitamin B12: catalysis by cobalamin-dependent enzymes". Annual Review of Biochemistry. 72: 209–47. doi:10.1146/annurev.biochem.72.121801.161828. PMID 14527323.
- ↑ Banerjee, RV; Matthews, RG (1990). "Cobalamin-dependent methionine synthase". The FASEB Journal. 4 (5): 1450–9. PMID 2407589.
- ↑ Wickramasinghe, SN (1995). "Morphology, biology and biochemistry of cobalamin- and folate-deficient bone marrow cells". Baillière's Clinical Haematology. 8 (3): 441–59. doi:10.1016/S0950-3536(05)80215-X. PMID 8534956.
- ↑ Naidich, MJ; Ho, SU (2005). "Case 87: Subacute combined degeneration". Radiology. 237 (1): 101–5. doi:10.1148/radiol.2371031757. PMID 16183926.
- ↑ "CerefolinNAC® Caplets" (PDF). intetlab.com. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2018-09-20. สืบค้นเมื่อ 2016-12-18.
- ↑ Marks, Allan D (2009). Basic Medical Biochemistry: A Clinical Approach (3rd ed.). Lippincott Williams & Wilkins. pp. 757. ISBN 078177022X.
- ↑ Beck, Melinda (2011-01-18). "Sluggish? Confused? Vitamin B12 May Be Low". The Wall Street Journal.
- ↑ Allen, RH; Seetharam, B; Podell, E; Alpers, DH (1978). "Effect of Proteolytic Enzymes on the Binding of Cobalamin to R Protein and Intrinsic Factor". The Journal of Clinical Investigation. 61 (1): 47–54. doi:10.1172/JCI108924. PMC 372512. PMID 22556.
- ↑ 73.0 73.1 Combs GF (2008). The vitamins: fundamental aspects in nutrition and health (3rd ed.). Amsterdam: Elsevier Academic Press. pp. 381–98. ISBN 978-0-12-183492-0. OCLC 150255807.
- ↑ Abels, J.; Vegter, J. J. M.; Woldring, M. G.; Jans, J. H.; Nieweg, H. O. (2009). "The Physiologic Mechanism of Vitamin B12 Absorption". Acta Medica Scandinavica. 165 (2): 105–113. doi:10.1111/j.0954-6820.1959.tb14477.x.
- ↑ Kuzminski, AM; Del Giacco, EJ; Allen, RH; Stabler, SP; Lindenbaum, J (August 1998). "Effective treatment of cobalamin deficiency with oral cobalamin". Blood. 92 (4): 1191–1198. PMID 9694707.
- ↑ Voet, Donald; Voet, Judith G (2010). Biochemistry. New York: J. Wiley & Sons. p. 957. ISBN 978-0470-57095-1.
- ↑ Larry E. Johnson. "Vitamin B12 Deficiency (Pernicious Anemia)". Merck Sharp & Dohme.
If a person stops consuming the vitamin, the body’s stores of this vitamin usually take about 3 to 5 years to exhaust
- ↑ "B12: An essential part of a healthy plant-based diet". International Vegetarian Union.
- ↑ "Mary Shorb Lecture in Nutrition". College of Agriculture and Natural Resources, University of Maryland. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2019-08-30. สืบค้นเมื่อ 2016-03-03.
- ↑ 80.0 80.1 "Dr. Mary Shaw Shorb - Annual Lecture". Department of Animal & Avian Sciences, University of Maryland. 2012-05-10. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2012-12-12. สืบค้นเมื่อ 2016-12-18.
- ↑ Kirkland, Kyle (2010). Biological Sciences: Notable Research and Discoveries. Facts on File, Inc. p. 87. ISBN 0816074399.
แหล่งข้อมูลอื่น
แก้- Cyanocobalamin, Hydroxocobalamin, Methylcobalamin, "Adenosylcobalamin". Drug Information Portal. U.S. National Library of Medicine.