กรดน้ำส้ม
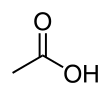
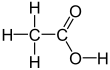
กรดน้ำส้ม หรือ กรดแอซีติก[8] (อังกฤษ: acetic acid) หรือมีชื่อตามระบบว่า กรดเอทาโนอิก เป็นสารประกอบอินทรีย์ในสถานะของเหลวไร้สี มีสูตรเคมีว่า CH3COOH (บ้างเขียนเป็น CH3CO2H หรือ C2H4O2) น้ำส้มสายชูมีกรดแอซีติกตั้งแต่ 4% ต่อปริมาตรขึ้นไป ทำให้กรดแอซีติกเป็นส่วนประกอบหลักของน้ำส้มสายชูนอกจากน้ำ กรดแอซีติกยังมีรสเปรี้ยวและกลิ่นฉุนเฉพาะตัว นอกจากน้ำส้มสายชูในครัวเรือนแล้ว ยังมีการผลิตกรดแอซีติกเป็นสารตั้งต้นของพอลีไวนิลแอซีเตด และเซลลูโลสแอซีเตด จัดเป็นกรดอ่อนเนื่องจากแตกตัวบางส่วนในสารละลาย แต่กรดแอซีติกเข้มข้นมีฤทธิ์กัดกร่อนและสามารถระคายเคืองผิวหนังได้
| |||
| |||

| |||
| ชื่อ | |||
|---|---|---|---|
| Preferred IUPAC name
กรดแอซีติก[3] | |||
| ชื่ออื่น | |||
| เลขทะเบียน | |||
3D model (JSmol)
|
|||
| 3DMet | |||
| ตัวย่อ | AcOH | ||
| 506007 | |||
| ChEBI | |||
| ChEMBL | |||
| เคมสไปเดอร์ | |||
| ดรักแบงก์ | |||
| ECHA InfoCard | 100.000.528 | ||
| EC Number |
| ||
| เลขอี | E260 (preservatives) | ||
| 1380 | |||
| KEGG | |||
| MeSH | Acetic+acid | ||
ผับเคม CID
|
|||
| RTECS number |
| ||
| UNII | |||
| UN number | 2789 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| คุณสมบัติ | |||
| C2H4O2 | |||
| มวลโมเลกุล | 60.052 g·mol−1 | ||
| ลักษณะทางกายภาพ | ของเหลวไร้สี | ||
| กลิ่น | เหมือนน้ำส้มสายชู | ||
| ความหนาแน่น | 1.049 g cm−3 (เหลว); 1.27 g cm−3 (แข็ง) | ||
| จุดหลอมเหลว | 16–17 องศาเซลเซียส; 61–62 องศาฟาเรนไฮต์; 289–290 เคลวิน | ||
| จุดเดือด | 118–119 องศาเซลเซียส; 244–246 องศาฟาเรนไฮต์; 391–392 เคลวิน | ||
| เข้ากันได้ | |||
| log P | -0.28[4] | ||
| ความดันไอ | 11.6 mmHg (20 °C)[5] | ||
| pKa | 4.756 | ||
| เบส | แอซิเตต | ||
| -31.54·10−6 cm3/mol | |||
ดัชนีหักเหแสง (nD)
|
1.371 (VD = 18.19) | ||
| ความหนืด | 1.22 mPa s | ||
| 1.74 D | |||
| อุณหเคมี | |||
ความจุความร้อน (C)
|
123.1 J K−1 mol−1 | ||
Std molar
entropy (S⦵298) |
158.0 J K−1 mol−1 | ||
Std enthalpy of
formation (ΔfH⦵298) |
-483.88–483.16 kJ mol−1 | ||
Std enthalpy of
combustion (ΔcH⦵298) |
-875.50–874.82 kJ mol−1 | ||
| เภสัชวิทยา | |||
| G01AD02 (WHO) S02AA10 | |||
| ความอันตราย | |||
| GHS labelling: | |||
 
| |||
| อันตราย | |||
| H226, H314 | |||
| P280, P305+P351+P338, P310 | |||
| NFPA 704 (fire diamond) | |||
| จุดวาบไฟ | 40 องศาเซลเซียส (104 องศาฟาเรนไฮต์; 313 เคลวิน) | ||
| 427 องศาเซลเซียส (801 องศาฟาเรนไฮต์; 700 เคลวิน) | |||
| ขีดจำกัดการระเบิด | 4–16% | ||
| ปริมาณหรือความเข้มข้น (LD, LC): | |||
LD50 (median dose)
|
3.31 g kg−1, oral (rat) | ||
LC50 (median concentration)
|
5620 ppm (mouse, 1 hr) 16000 ppm (rat, 4 hr)[7] | ||
| NIOSH (US health exposure limits): | |||
PEL (Permissible)
|
TWA 10 ppm (25 mg/m3)[6] | ||
REL (Recommended)
|
TWA 10 ppm (25 mg/m3) ST 15 ppm (37 mg/m3)[6] | ||
IDLH (Immediate danger)
|
50 ppm[6] | ||
| สารประกอบอื่นที่เกี่ยวข้องกัน | |||
กรดคาร์บอกซิลิกที่เกี่ยวข้อง
|
กรดฟอร์มิก กรดโพรพิโอนิก | ||
สารประกอบที่เกี่ยวข้อง
|
แอซีทาลดีไฮด์ แอเซตาไมด์ แอซิติกแอนไฮไดรด์ แอซิโตไนไตรล์ แอซิติลคลอไรด์ เอทานอล เอทิลแอซิเตต โพแทสเซียมแอซิเตต โซเดียมแอซิเตต กรดไทโอแอซิติก | ||
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |||
กรดแอซีติกเป็นกรดคาร์บ็อกซิลิกที่เรียบง่ายที่สุดเป็นอันดับสอง (รองจากกรดฟอร์มิก) ประกอบด้วยหมู่เมทิลต่อกับหมู่คาร์บ็อกซิล กรดแอซีติกเป็นสารเคมีสำคัญและสารเคมีอุตสาหกรรม ซึ่งใช้เป็นหลักในการผลิตเซลลูโลสแอซีเตดสำหรับภาพยนตร์ภาพถ่าย พอลีไวนิลแอซีเตดสำหรับกาวทาไม้ และใยและเส้นใยสังเคราะห์ ในครัวเรือน กรดแอซีติกเจือจางใช้เป็นสารขจัดตะกรัน
การตั้งชื่อ
แก้นักเคมีและสหภาพเคมีบริสุทธิ์และเคมีประยุกต์ระหว่างประเทศ (IUPAC) นิยมใช้ชื่อสามัญ "กรดแอซีติก" ขณะที่ชื่อตามระบบคือ "กรดเอทาโนอิก"[9] ชื่อกรดแอซีติกมีรากศัพท์มาจากคำภาษาลาติน acetum แปลว่าน้ำส้มสายชู
กรดแกลเชียลแอซีติก เป็นชื่อสำหรับกรดแอซีติกที่ปราศจากน้ำ (anhydrous) โดยชื่อนี้ (ซึ่งความหมายคล้ายกับคำภาษาเยอรมัน Eisessig แปลว่าน้ำแข็งน้ำส้มสายชู) มาจากโครงสร้างผลึกที่มีลักษณะคล้ายน้ำแข็ง ซึ่งก่อตัวเมื่อต่ำกว่าอุณภูมิห้องเล็กน้อยที่ 16.6 องศาเซลเซียส (61.9 องศาฟาเรนไฮต์) (น้ำ 0.1% ทำให้จุดหลอมเหลวชองสารลดลง 0.2 °C)[10]
เครื่องหมายสามัญของกรดแอซีติกคือ AcOH โดยที่ Ac เป็นสัญลักษณ์แทนหมู่แอซีทิล (acetyl group) CH
3−C(=O)− ในขณะที่มีคู่เบสเป็นแอซิเตตไอออน CH
3COO− และแทนโดย AcO−[11] (ในที่นี้ Ac ไม่ใช่สัญลักษณ์ของธาตุแอกทิเนียม) โครงสร้างเคมีของกรดแอซีติกมักเขียนดังนี้ CH
3–C(O)OH CH
3−C(=O)OH CH
3COOH และ CH
3CO
2Hเมื่อกล่าวถึงปฏิกิริยายาระหว่างกรดและเบส มักใช้สัญลักษณ์ HAc[12] โดยที่ Ac แทนเป็นแอซิเตตไอออน แอซิเตตคือไอออนที่เกิดจากการที่กรดแอซีติกเสีย H+
ชื่อแอซิเตตอาจเป็นเกลือที่มีแอนไอออนหรือเอสเทอร์ของกรดแอซีติก[13]
คุณสมบัติ
แก้ความเป็นกรด
แก้ไฮโดรเจนอตอมในกลุ่มคาร์บอกซิล (−COOH) ในกรดคาร์บอกซิลิกเช่น กรดแอซีติก สามารถแยกตัวออกจากโมเลกุลด้วยวิธีไอออไนเซชัน (ionization):
- CH3CO2H ⇌ CH3CO2− + H+
กรดแอซีติกมีความเป็นกรดเพราะสามารถแตกตัวในน้ำและให้โปรตอน (H+) กรดแอซีติกเป็นกรดอ่อนที่สามารถให้โปรตอนได้เพียงตัวเดียว (monoprotic acid) กรดแอซีติกในสารละลายมี pKa = 4.76 (ค่าคงที่การแตกตัวของกรด)[14] คู่เบสของกรดนี้คือแอซิเตตไอออน (CH3COO−) สารละลายที่มีความเข้มข้น 1.0 M (เทียบเท่ากับความเข้มข้นของน้ำส้มสายชูทั่วไป) มี pH =2.4 ซึ่งบ่งบอกว่ามีเพียงแค่ 0.4% โมเลกุลของกรดแอซีติกที่แตกตัว[15] แต่ทว่าถ้าสารละลายมีความเข้มข้นที่ต่ำมาก (< 10−6 M) ค่าการแตกตัวของโมเลกุลกรดแอซีติกเพิ่มขึ้นมากกว่า 90%
โครงสร้างสาร
แก้โมเลกุลของแข็งของกรดแอซีติกก่อตัวเป็นห่วงโซ่ โดยที่โมเลกุลแต่ล่ะอันต่อกันด้วยพันธะไฮโดรเจน[16] โมเลกุลแก๊สกรดแอซีติกจะเชื่อมและสร้างโครงสร้างไดเมอร์เมื่อมีอุณภูมิถึง 120 องศาเซลเซียส (248 องศาฟาเรนไฮต์) โครงสร้างไดเมอร์ของกรดแอซีติกเกิดขึ้นในสถานะของเหลวเช่นกันเมื่อสารละลายมีความเข้มข้นของกรดน้อยและตัวทำละลายที่ไม่สร้างพันธะไฮโดรเจน เกิดขึ้นในกรดแอซีติกบริสุทธิ์เล็กน้อย[17]แต่โครงสร้างมักจะถูกรบกวนโดยตัวทำละลายที่สร้างพันธะไฮโดรเจน เอนทาลปีการแยกตัวของโครงสร้างไดเมอร์มีค่าประมาณ 65.0–66.0 kJ/mol เอนโทรปีการแยกตัวมีค่าประมาณ 154–157 J mol−1 K−1[18] กรดคาร์บอกซิลิกชนิดอื่นมีพฤติกรรมการสร้างพันธะไฮโดรเจนระหว่างโมเลกุลคล้ายคลึงกับกรดแอซีติก[19]
คุณสมบัติของตัวทำละลาย
แก้กรดแอซิติกในสถานะของเหลวเป็นตัวทำละลายที่ละลายในน้ำได้ดี (เนื่องจากมีขั้ว) และสามารถให้โปรตอนได้ เช่นเดียวกับเอทานอลและน้ำ เนื่องจากกรดแอซิติกมีค่าคงที่ไดอิเล็กทริก (dielectric constant) ในระดับปานกลางเท่ากับ 6.2 ทำให้กรดแอซิติกสามารถละลายได้ทั้งในสารที่มีขั้วเช่น เกลืออนินทรีย์และน้ำตาล และสารที่ไม่มีขั้วเช่น น้ำมัน สารละลายที่ได้จากการผสมของกรดแอซิติกและตัวทำละลายที่มีขั้วและไม่มีเช่น น้ำ คลอโรฟอร์ม และเฮกเซน เป็นสารเนื้อเดียว แต่ทว่าเมื่อผสมกรดแอซิติกกับตัวทำลายที่มีความเป็นด่างสูงเช่น ออกเทน (octane) สารละลายที่ได้จะเป็นสารเนื้อผสม นอกจากนี้ความสามารถในการสร้างสารเนื้อเดียวเมื่อผสมกรดแอซิติกกับตัวทำละลายจะน้อยลงเมื่อตัวทำละลายมีโครงแอลเคนที่ยาว[20] คุณสมบัติตัวทำละลายและการทำให้เป็นเนื้อเดียวของกรดแอซิติกสร้างประโยชน์ให้กับทางอุตสาหกรรมทางเคมีเช่น การนำกรดแอซิติกเป็นตัวทำละลายในการผลิตไดเมธิลเทเรฟธาเลต (Dimethyl terephthalate)[21]
ชีวเคมี
แก้ณ pH ในร่างกาย กรดแอซิติกมักที่จะแยกตัวเป็นโปรตอนและแอซิเตตอย่างสมบูรณ์ หมู่แอซีทิลซึ่งได้มากจากกรดแอซิติกเป็นพื้นฐานสำคัญสำหรับสิ่งมีชีวิตทุกรูปแบบ แอซิติลโคเอนไซม์ เอ มีความสำคัญในการย่อยสลายอาหารจำพวกคาร์โบไฮเดรตและไขมัน กรดแอซิติกไม่เหมือนกับกรดคาร์บอกซิลิกที่มีโมเลกุลที่ยาว (กรดไขมัน) ตรงที่ว่ากรดแอซิติกไม่มีอยู่ในไตรกลีเซอไรด์ตามธรรมชาติ แต่ทว่าไตรกลีเซอไรด์ แอซีตินเป็นไตรกลีเซอไรด์เทียมที่มักจะถูกใช้เป็นสารเจือปนอาหาร ประทิ่น และยาทา[22] แบคที่เรียโดยเฉพาะสกุลแอซีโตแบคเตอร์ (Acetobacter) และเชื้อจุลินทรีย์ Clostridium acetobutylicum สามารถผลิตและหลั่งกรดแอซิติกได้ แบคทีเรียเหล่านี้มักจะถูกพบเจอทั่วโลกในอาหาร น้ำ และ ดิน นอกจากนี้กรดแอวิติกสามารถถูกผลิตโดยผลไม้และอาหารอื่น ๆ เมื่อเสีย กรดแอซิติกยังเป็นวัถุดิบสำคัญในการผลิตสารหล่อลื่นช่องคลอดของมนุษย์และสัตว์อันดับวานรอื่น ๆ โดยกรดแอซิติกมีหน้าที่เป็นยาปฏิชีวนะเพื่อช่วยยับยั้งการเจริญเติบโตของแบคทีเรีย[23]
การผลิต
แก้การผลิตกรดน้ำส้มในอุตสาหกรรมใช้ทั้งการสังเคราะห์โดยตรงและการหมักโดยแบคทีเรีย ร้อยละ 75 ของกรดแอซิติกที่ใช้ในอุตสาหกรรมเคมีมาจากปฏิกิริยาคาร์บอนิลเลชันของเมทานอล[24] อีกเพียงร้อยละ 10 มาจากกระบวนการทางชีววิทยา แต่ส่วนนี้มีความสำคัญเนื่องจากกฎหมายควบคุมอาหารในบางสถานที่ บังคับให้น้ำส้มสายชูในอาหารต้องมาจากธรรมชาติ กระบวนการอื่นประกอบด้วยไอโซเมอไรเซชันเมทิลฟอร์เมท การแปลงซินแก๊สเป็นกรดน้ำส้ม และปฏิกิริยาอ็อกซิเดชันสถานะแก๊สของเอทีลีนและเอทานอล บ่อยครั้งกรดน้ำส้มเป็นผลิตภัณฑ์ข้างเคียงของปฏิกิริยาต่าง ๆ คือ ระหว่างการสังเคราะห์กรดอะครีลิกแคทาลิติกซึ่งไม่เป็นเนื้อเดียวกัน หรือการผลิตกรดแลกติกด้วยการหมัก ในปี 2003–2005 การผลิตกรดน้ำส้มบริสุทธิ์ทั่วโลกรวมมีการประเมินไว้ที่ 5 ล้านตันต่อปี ในจำนวนนี้ราวกึ่งหนึ่งมีการผลิตในสหรัฐ การผลิตของยุโรปอยู่ที่ประมาณ 1 ล้านตันต่อปี และการผลิตของญี่ปุ่นอยู่ที่ 0.7 ล้านตันต่อปี มีการรีไซเคิลอีก 1.5 ล้านตันต่อปี ทำให้ตลาดโลกรวมมีปริมาณ 6.5 ล้านตันต่อปี นับแต่นั้นการผลิตทั่วโลกเพิ่มขึ้นเป็น 10.7 ล้านตันต่อปี (ในปี 2010) และเพิ่มขึ้นเรื่อย ๆ อย่างไรก็ดีมีการทำนายว่าการผลิตดังกล่าวจะเพิ่มขึ้นในอัตราช้าลง ผู้ผลิตกรดน้ำส้มบริสุทธิ์รายใหญ่สุดของโลก ได้แก่ Celanese และ BP Chemicals
คาร์บอนิลเลชันของเมทานอล
แก้กรดแอซิติกส่วนใหญ่มาจากการทำปฏิกิริยาคาร์บอนิลเลชันของเมทานอล โดยเมทานอลทำปฏิกิริยากับคาร์บอนมอนอกไซด์เกิดเป็นกรดแอซิติกตามสมการ
กระบวนการนี้มีไอโอโดมีเทนเป็นสารตัวกลาง และเกิดขึ้นในสามขั้นตอน จำเป็นต้องใช้คาร์บอนิลโลหะสำหรับปฏิกิริยาคาร์บอนิเลชัน (ขั้นที่ 2)[25]
- CH3OH + HI → CH3I + H2O
- CH3I + CO → CH3COI
- CH3COI + H2O → CH3COOH + HI
มีกระบวนการที่เกี่ยวข้องกันสองกระบวนการสำหรับปฏิกิริยาคาร์บอนิเลชันของเมทานอล ได้แก่ กระบวนการมอนซานโตที่มีโรเดียมเป็นตัวเร่งปฏิกิริยา และกระบวนการคาติวาที่มีอิริเดียมเป็นตัวเร่งปฏิกิริยา กระบวนการคาติวานี้เป็นมิตรต่อสิ่งแวดล้อมและมีประสิทธิภาพมากกว่า และเริ่มใช้กันแพร่หลายมากกว่ากระบวนการมอนซานโตแล้ว มีการใช้น้ำเป็นตัวเร่งปฏิกิริยาในกระบวนการทั้งสอง แต่กระบวนการคาติวาใช้น้ำน้อยกว่า ดังนั้นปฏิกิริยาการเลื่อนน้ำ-แก๊สจะถูกระงับ และเกิดผลิตภัณฑ์ข้างเคียงน้อยกว่า
เมื่อมีการเปลี่ยนแปลงสภาพกระบวนการ แอซิติกแอนไฮไดรด์อาจถูกผลิตขึ้นจากสถานที่ผลิตเดียวกันโดยใช้ตัวเร่งปฏิกิริยาโรเดียม
อ็อกซิเดชันของอะเซตัลดีไฮด์
แก้ก่อนมีการใช้กระบวนการมอนซานโตในเชิงพาณิชย์ กรดน้ำส้มส่วนใหญ่ผลิตขึ้นจากปฏิกิริยาอ็อกซิเดชันของอะเซตัลดีไฮด์ ปัจจุบันกระบวนการนี้ยังเป็นวิธีการผลิตที่สำคัญที่สุดเป็นอันดับที่ 2 แม้ปกติจะไม่สามารถแข่งขันกับปฏิกิริยาคาร์บอนิเลชันของเมทานอลได้ อะเซตัลดีไฮด์นี้สามารถผลิตได้จากปฏิกิริยาไฮเดรชันของอะเซทีลีน ซึ่งเป็นเทคโนโลยีที่ใช้กันมากที่สุดในช่วงต้นคริสต์ศตวรรษที่ 20
องค์ประกอบแนฟทาเบาถูกอ็อกซิไดซ์อย่างรวดเร็วโดยอ็อกซิเจนหรืออากาศเกิดเป็นเปอร์อ็อกไซด์ ซึ่งย่อยสลายเป็นกรดน้ำส้ม ดังสมการเคมีที่แสดงด้วยบิวเทน
- 2 C4H10 + 5 O2 → 4 CH3CO2H + 2 H2O
ปฏิกิริยาอ็อกซิเดชันดังกล่าวต้องใช้ตัวเร่งปฏิกิริยาโลหะ เช่น เกลือแนฟทีเนตของแมงกานีส โคอลต์และโครเมียม
ตรงแบบจะมีการดำเนินปฏิกิริยาที่อุณหภูมิและความดันที่ออกแบบมาให้มีอุณหภูมิสูงสุดที่เป็นไปได้ ขณะที่ยังให้บิวเทนมีสถานะของเหลว สภาพปฏิกิริยาตรงแบบคือ อุณหภูมิ 150 °C และความดัน 55 บรรยากาศ อาจมีผลิตภัณฑ์ข้างเคียงเกิดขึ้นได้ เช่น บิวทาโนน เอทิลแอซิเตด กรดฟอร์มิกและกรดโพรไพโอนิก ผลิตภัณฑ์ข้างเคียงเหล่านี้ยังสามารถขายได้ราคาดี และอาจมีการปรับเปลี่ยนสภาวะของปฏิกิริยาเพื่อให้ผลิตสารเหล่านี้มากขึ้นได้ตามต้องการ อย่างไรก็ดี หากต้องการแยกกรดน้ำส้มจากผลิตภัณฑ์ข้างเคีคยงเหล่านี้จะทำให้กระบวนการมีต้นทุนสูงขึ้น
ภายใต้สภาวะที่คล้ายกันและใช้ตัวเร่งปฏิกิริยาอย่างเดียวกันกับที่ใช้ในปฏิกิริยาอ็อกซิเดชันของบิวเทน อ็อกซิเจนในอากาศสามารถอ็อกซิไดซ์อะเซตัลดีไฮด์เพื่อผลิตกรดน้ำส้มได้
- 2 CH3CHO + O2 → 2 CH3CO2H
ปฏิกิริยานี้เมื่อใช้ตัวเร่งปฏิกิริยาสมัยใหม่สามารถมีอัตราผลิตกรดน้ำส้มกว่าร้อยละ 95 ผลิตภัณฑ์ข้างเคียงที่สำคัญ คือ เอทิลแอซิเตด กรดฟอร์มิกและฟอร์มัลดีไฮด์ ทั้งหมดมีจุดหลอมเหลวต่ำกว่ากรดน้ำส้มและสามารถแยกได้อย่างรวดเร็วโดยการกลั่น
ออกซิเดชันของเอทีลีน
แก้อะเซตัลดีไฮด์อาจเตรียมได้จากเอทีลีนด้วยกระบวนการวักเคอร์ แล้วจึงอ็อกซิไดซ์ตามปฏิกิริยาข้างต้น
ในสมัยหลัง บริษัทเคมี โชวะเด็งโกะ ซึ่งเปิดโรงอ็อกซิเดชันเอทีลีนในจังหวัดโออิตะของญี่ปุ่นในปี 1997 เป็นผู้ขายการแปลงเอทีลีนเป็นกรดน้ำส้มโดยใช้ขั้นตอนเดียวและมีราคาถูกกว่า กระบวนการดังกล่าวมีตัวเร่งปฏิกิริยาโลหะพัลเลเดียม เพิ่มเติมจากกรดเฮเทอโรพอลี เช่น กรดซิลิโกทังสติก กระบวนการคล้ายกันยังใช้ตัวเร่งปฏฺิกิริยาโลหะเดียวกันกับกรดซิลิโกทังสติกและซิลิกา
- C2H4 + O2 → CH3CO2H
คาดกันว่าปฏิกิริยานี้แข่งขันได้กับปฏิกิริยาคาร์บอนิเลชันของเมทานอลสำหรับโรงผลิตขนาดเล็กกว่า (1–2.5 แสนตันต่อปี) ขึ้นกับราคาเอทีลีนในท้องถิ่นนั้น ๆ วิธีการนี้จะอาศัยการใช้ประโยชน์จากเทคโนโลยีอ็อกซิเดชันเร่งปฏิกิริยาด้วยแสงเจาะจงแบบใหม่สำหรับอ็อกซิเดชันของเอทีลีนและอีเทนแบบเลือกเป็นกรดน้ำส้ม กระบวนการอ็อกซิเดชันแบบเลือกนี้ต่างจากตัวเร่งปฏิกิริยาอ็อกซิเดชันแบบเดิมตรงที่ใช้แสงยูวีเพื่อผลิตกรดน้ำส้มที่อุณหภูมิและความดันโดยรอบ
การหมักแบบใช้อ็อกซิเจน
แก้ในประวัติศาสตร์ส่วนใหญ่ของมนุษย์ใช้แบคทีเรียในสกุล Acetobacter ผลิตกรดน้ำส้ม ในรูปของน้ำส้มสายชู เมื่อมีอ็อกซิเจนเพียงพอ แบคทีเรียเหล่านี้สามารถผลิตน้ำส้มสายชูได้ได้จากอาหารที่มีแอลกอฮอลหลายอย่าง อาหารที่ใช้เลี้ยงแบคทีเรียกันทั่วไป ได้แก่ ไซเดอร์แอปเปิล ไวน์ และธัญพืช มอลต์ ข้าวหรือมันฝรั่งบดหมัก ปฏิกิริยาเคมีรวมที่เกิดขึ้นจากแบคทีเรียดังกล่าว คือ
- C2H5OH + O2 → CH3COOH + H2O
เมื่อใส่ Acetobacter ลงในสารละลายแอลกอฮอลเจือจาง แล้วเก็บรักษาไว้ในที่อบอุ่นและอากาศถ่ายเท จะเกิดน้ำส้มสายชูเมื่อเวลาผ่านไปไม่กี่เดือน วิธีการผลิตน้ำส้มสายชูระดับอุตสาหกรรมจะเร่งกระบวนการนี้โดยการเพิ่มปริมาณอ็อกซิเจนให้แก่แบคทีเรีย
น้ำส้มสายชูที่เกิดจากการหมักในยุคแรก ๆ อาจเกิดขึ้นหลังข้อผิดพลาดในกระบวนการผลิตไวน์ ถ้ามีการหมักน้ำผลไม้คั้นใหม่หรือไวน์ใหม่ (must) ที่อุณหภูมิสูงเกิดไป แบคทีเรีย Acetobacter จะเพิ่มจำนวนมากกว่ายีสต์ที่เกิดขึ้นตามธรรมชาติในองุ่น เมื่อมีอุปสงค์สำหรับน้ำส้มสายชูมากขึ้นเพื่อวัตถุประสงค์ในการประกอบอาหาร การแพทย์ และการสุขาภิบาล ผู้ผลิตไวน์จึงรู้จักใช้สารอินทรีย์อื่นในการผลิตน้ำส้มสายชูในฤดูร้อนก่อนองุ่นสุกและพร้อมแปรรูปเป็นไวน์ ทว่าวิธีการนี้ใช้เวลานาน และไม่ประสบความสำเร็จเสมอไป เพราะไม่เข้าใจกระบวนการ
กระบวนการผลิตน้ำส้มสายชูเชิงการค้าสมัยใหม่แรก ๆ คือ "วิธีเร็ว" หรือ "วิธีเยอรมัน" ซึ่งริเริ่มขึ้นในปี 1823 ในกระบวนการนี้ การหมักจะเกิดขึ้นในหอคอยที่อัดแน่นด้วยแผ่นไม้หรือถ่าน อาหารที่มีแอลกอฮอลจะถูกเทลงมาจากยอดหอคอย และเปิดให้อากาศเข้าได้จากด้านล่างด้วยการพาตามธรรมชาติหรือบังคับ กระบวนการนี้มีปริมาณอากาศเพิ่มขึ้นช่วยย่นเวลาการเตรียมน้ำส้มสายชูจากหลายเดือนลงเหลือหลายสัปดาห์
ปัจจุบันน้ำส้มสายชูส่วนใหญ่ผลิตในการเพาะเลี้ยงในถังใต้น้ำ ซึ่งมีการอธิบายครั้งแรกในปี 1949 โดย Otto Hromatka และ Heinrich Ebner ในวิธีการนี้จะมีการหมักแอลกอฮอลในถังที่มีการคนหรือกวนอยู่ตอลดเวลา และมีการใส่อ็อกซิเจนโดยอัดอากาศผ่านสารละลาย การใช้วิธีการสมัยใหม่นี้ทำให้น้ำส้มสายชูที่มีกรดน้ำส้ม 15% สามารถผลิตได้ในเวลา 24 ชั่วโมงในกระบวนการครั้งหนึ่ง หรืออาจถึง 20% ในกระบวนการ 60 ชั่วโมง
การหมักโดยไม่ใช้ออกซิเจน
แก้ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
การใช้งาน
แก้ไวนิลแอซีเตตโมโนเมอร์
แก้กรดแอซิติกถูกใช้ในการผลิตไวนิล แอซีเตตโมโนเมอร์ (vinyl acetate monomer) ในปี 2008 การผลิตสารชนิดนี้ถูกคาดการว่าบริโภคกรดแอซิติกจำนวนหนึ่งส่วนสามของการผลิตกรดแอซิติกของโลก ปฏิกิริยานี้เริ่มจากการนำสารในสถานะแก๊ส เอทิลีน ออกซิเจน และกรดแอซีติก มาผ่านด้วยตัวเร่งปฏิกิริยาแพลเลเดียม[21] The reaction consists of ethylene and acetic acid with oxygen over a palladium catalyst, conducted in the gas phase.[26]
- 2 H3C−COOH + 2 C2H4 + O2 → 2 H3C−CO−O−CH=CH2 + 2 H2O
ไวนิล แอซีเตดสามารถรวมตัวเป็นลูกโซ่และกลายเป็นพอลิไวนิล แอซีเตตหรือพอลิเมอร์อื่น ๆ ซึ่งเป็นวัตถุดิบในการผลิตสีและกาว[26]
การผลิตเอสเตอร์
แก้เอสเทอร์หลักของกรดแอซิติกเช่น เอทิลแอซิเตต (ethyl acetate) เอ็น-บิวทิลแอซิเตต (n-butyl acetate) ไอโซบิวทิลแอซีเตต (isobutyl acetate) โพรพิวแอซีเตต (propyl acetate) ถูกใช้เป็นตัวทำละลายสำหรับหมึก สี และน้ำยาเคลือบ โดยทั่วไปแอซิติกเอสเทอร์เหล่านี้จะถูกผลิตด้วยปฏิกิริยาเร่งระหว่างกรดแอซิติกและแอลกอฮอล์:
- H3C−COOH + HO−R → H3C−CO−O−R + H2O, (R = หมู่แอลคิล (alkyl group) ทั่วไป)
แต่ทว่าเอสเทอร์ส่วนมากถูกผลิตด้วยปฏิกิริยา Tishchenko โดยใช้แอซีทาลดีไฮด์ (acetaldehyde) นอกจากนี้เอสเทอร์แอซิเตตถูกใช้เป็นตัวทำละลายสำหรับไนโตรเซลลูโลส (nitrocellulose) สีพ่นอะคริลิคแลคเกอร์ น้ำยาล้างเคลือบผิวไม้ และสีทาไม้ ไกลคอลโมโนอีเธอร์ (glycol monoethers) ถูกผลิตโดยใช้เอทิลีนออกไซด์ (ethylene oxide) หรือโพรพิวลีนออกไซด์ (propylene oxide) กับแอลกอฮอล์ และเพื่อมาทำปฏิกิริยากับกรดแอซิติก สามผลิตภัณฑ์หลักจากปฏิกิริยานี้คือ เอทิลีนไกลคอลโมโนเอทิลอีเธอร์แอซิเตต (glycol monoethyl ether acetate, EEA) เอทิลีนไกลคอลโมโนบิวทิลอีเธอร์แอซิเตต (thylene glycol monobutyl ether acetate, EBA) และโพรไพลีนไกลคอลโมโนเมททิลอีเธอร์แอซิเตต (propylene glycol monomethyl ether, PMA, หรือ PGMEA เป็นชื่อที่นิยมใช้ในกระบวนการผลิตสารกึ่งตัวนำ โดยมีสารนี้เป็นตัวทำละลาย) ร้อยละ 15 ถึง 20 ของกรดแอซิเตกทั้งหมดถูกใช้เพื่อการผลิตสารนี้ อีเธอร์แอซิเตต เช่น EEA ถูกพบว่ามีผลอันตรายต่อการสืบพันธุ์ของมนุษย์[27]
แอซิติกแอนไฮดรายด์
แก้แอซิติกแอนไฮดรายด์ (acetic anhydride) เกิดจากการควบแน่นของสองโมเลกุลของกรดแอซิติก เนื่องจากสารชนิดนี้มีการใช้งานที่หลากหลาย ร้อยละ 25 ถึง 30 ของกรดแอซิติกทั้งหมดถูกใช้เพื่อการผลิตสารชนิดนี้ โดยขั้นตอนในการผลิตแอซิติกแอนไฮดรายด์มีการดึงโมเลกุลน้ำออกจากกรดแอซิติกในอุณภูมิ 700- ถึง 750 °C เพื่อให้โมเลกุลมีโครงสร้างเป็นคีทีน (ketene) หลังจากนั้นคีทีนจะทำปฏิกิริยากรดแอซิติกเพื่อผลิตแอนไฮดรายด์:[28]
- CH3CO2H → CH2=C=O + H2O
- CH3CO2H + CH2=C=O → (CH3CO)2O
แอซิติกแอนไฮดรายด์สามารถทำหน้าที่เป็นสารเพิ่มกลุ่มแอเซทิล (acetylation agent) เพราะฉะนั้นแล้วแอซิติกแอนไฮดรายด์ถูกใช้ในการผลิตเส้นใยแอซีเตต (cellulose acetate) ซึ่งเป็นเส้นใยสังเคราะห์ที่ใช้สำหรับผลิตแผ่นถ่ายรูป แอซิติกแอนไฮดรายด์ยังถูกใช้สำหรับผลิตเฮโรอีนและสารประกอบอื่น ๆ[28]
การใช้เป็นตัวทำละลาย
แก้ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
ประโยชน์ทางการแพทย์
แก้ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
อาหาร
แก้ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
ปฏิกิริยาทางเคมี
แก้ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
สารอินทรีย์
แก้ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
กรดแอซิติกสามารถทำปฏิกิริยาทั่วไปของกรดคาร์บอกซิลิก เมื่อทำปฏิกิริยากับสารละลายเบสทั่วไปจะให้เกลือแอซิเตตกับน้ำ (เช่น CH3COOH + NaOH → CH3COONa + H2O) หากใช้เบสที่แก่มาก (เช่นพวกออร์กาโนลิเทียม) อาจเกิดการเสียโปรตอนที่ตำแหน่งอัลฟาคาร์บอนด้วย (เช่น CH3COOH + 2CH3Li → LiCH2COOLi + 2CH4) การทำปฏิกิริยารีดักชันกรดแอซิติกให้แอเซตาลดีไฮด์และเอทานอลตามลำดับ กรดแอซิติกสามารถเกิดเป็นอนุพันธ์กรดคาร์บอกซิลิก เช่นแอซิติลคลอไรด์และแอซิติกแอนไฮดรายด์ รวมถึงการเกิดเอสเทอร์กับเอไมด์ เมื่อกรดแอซิติกถูกให้ความร้อนสูงกว่า 440 °C จะสลายตัวให้คาร์บอนไดออกไซด์กับมีเทน หรือคีทีนกับน้ำ:
CH3COOH → CH4 + CO2
CH3COOH → CH2=C=O + H2O
ปฏิกิริยาทางเคมีกับสารอนินทรีย์
แก้ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
กรดแอซิติกมีฤทธิ์กัดกร่อนพอประมาณต่อโลหะ เช่นแมกนีเซียม สังกะสี และเหล็ก เกิดเป็นแก๊สไฮโดรเจนกับเกลือแอซิเตต:
Mg + 2 CH3COOH → (CH3COO)2Mg + H2
สำหรับโลหะอะลูมิเนียม สามารถสร้างชั้นของอะลูมิเนียมออกไซด์ซึ่งทนกรดเคลือบผิวเอาไว้ ในการขนส่งกรดแอซิติกจึงมักบรรจุในภาชนะอะลูมิเนียม
เกลือแอซิเตตสามารถเตรียมได้อีกวิธี โดยการทำปฏิกิริยาระหว่างกรดแอซิติกกับเบสที่เหมาะสม เช่นปฏิกิริยาระหว่างน้ำส้มสายชูกับผงฟู:
NaHCO3 + CH3COOH → CH3COONa + CO2 + H2O
เกลือแอซิเตตทดสอบได้โดยการทำปฏิกิริยากับสารละลายไอเอิร์น(III)คลอไรด์ ให้สารเชิงซ้อนสีแดงเข้ม ซึ่งจะจางหายไปเมื่อทำให้สารละลายเป็นกรด[29] อีกวิธีการทดสอบที่ว่องไวกว่า คือการใช้แลนทานัมไนเตรต ไอโอดีน และแอมโมเนีย ซึ่งจะให้สารละลายสีฟ้า[30] นอกจากนี้การให้ความร้อนแก่เกลือแอซิเตตกับอาร์เซนิกไตรออกไซด์จะให้คาโคดิลออกไซด์ ซึ่งมีกลิ่นเหม็น[31]
สารอนุพันธ์อื่น
แก้ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
เกลือแอซิเตตที่มีความสำคัญทางพาณิชย์เช่น
- โซเดียมแอซิเตต ใช้ในอุตสาหกรรมสิ่งทอและเป็นสารกันบูด (E262)
- คอปเปอร์(I)แอซิเตต ใช้เป็นผงสีและสารฆ่าเชื้อรา
- อะลูมิเนียมแอซิเตต และไอเอิร์น(II)แอซิเตต ใช้เป็นมอร์แดนต์
- แพลเลเดียม(II)แอซิเตต ใช้เป็นตัวเร่งปฏิกิริยาในเคมีอินทรีย์ เช่น ปฏิกิริยาเฮค
กรดแอซิติกที่ถูกเติมแฮโลเจนที่มีความสำคัญทางพาณิชย์เช่น
- กรดคลอโรแอซิติก ใช้ในการสังเคราะห์สีย้อมคราม
- กรดโบรโมแอซิติก นำไปทำปฏิกิริยาเอสเทอริฟิเคชันได้เอทิลโบรโมแอซิเตต ซึ่งเป็นรีเอเจนต์
- กรดไตรฟลูออโรแอซิติก เป็นรีเอเจนต์ในเคมีอินทรีย์
กรดแอซิติกประมาณร้อยละ 5 - 10 ของกำลังผลิตทั่วโลกใช้ในการสังเคราะห์อนุพันธ์เหล่านี้[32]
ประวัติศาตร์
แก้ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
มวลสารระหว่างดาว
แก้ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
ผลกระทบต่อสุขภาพและความปลอดภัย
แก้ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
ดูเพิ่ม
แก้- กรดแอซิติก (หน้าข้อมูล)
- หมู่อะเซติล, หมู่ CH3-CO
- กรดในไวน์
- แอซิเตต
อ้างอิง
แก้- ↑ Scientific literature reviews on generally recognised as safe (GRAS) food ingredients. National Technical Information Service. 1974. p. 1.
- ↑ "Chemistry", volume 5, Encyclopædia Britannica, 1961, page 374
- ↑ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 745. doi:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
- ↑ "acetic acid_msds".
- ↑ Lange's Handbook of Chemistry, 10th ed.
- ↑ 6.0 6.1 6.2 NIOSH Pocket Guide to Chemical Hazards. "#0002". National Institute for Occupational Safety and Health (NIOSH).
- ↑ "Acetic acid". Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ↑ พจนานุกรมศัพท์วิทยาศาสตร์ คณิตศาสตร์ และเทคโนโลยี, สสวท. (สืบค้น "acetic")
- ↑ IUPAC Provisional Recommendations 2004 Chapter P-12.1; page 4
- ↑ Armarego, W.L.F.; Chai, Christina (2009). Purification of Laboratory Chemicals, 6th edition. Butterworth-Heinemann. ISBN 978-1-85617-567-8.
- ↑ Cooper, Caroline (9 August 2010). Organic Chemist's Desk Reference (2 ed.). CRC Press. pp. 102–104. ISBN 978-1-4398-1166-5.
- ↑ DeSousa, Luís R. (1995). Common Medical Abbreviations. Cengage Learning. p. 97. ISBN 978-0-8273-6643-5.
- ↑ Hendrickson, James B.; Cram, Donald J.; Hammond, George S. (1970). Organic Chemistry (3 ed.). Tokyo: McGraw Hill Kogakusha. p. 135.
- ↑ Goldberg, R.; Kishore, N.; Lennen, R. (2002). "Thermodynamic Quantities for the Ionization Reactions of Buffers" (PDF). Journal of Physical and Chemical Reference Data. 31 (2): 231–370. Bibcode:2002JPCRD..31..231G. doi:10.1063/1.1416902. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 6 October 2008.
- ↑ [H3O+] = 10−2.4 = 0.4%
- ↑ Jones, R. E.; Templeton, D.H. (1958). "The crystal structure of acetic acid". Acta Crystallographica. 11 (7): 484–487. doi:10.1107/S0365110X58001341.
- ↑ Briggs, James M.; Toan B. Nguyen; William L. Jorgensen (1991). "Monte Carlo simulations of liquid acetic acid and methyl acetate with the OPLS potential functions". Journal of Physical Chemistry. 95 (8): 3315–3322. doi:10.1021/j100161a065.
- ↑ Togeas, James B. (2005). "Acetic Acid Vapor: 2. A Statistical Mechanical Critique of Vapor Density Experiments". Journal of Physical Chemistry A. 109 (24): 5438–5444. Bibcode:2005JPCA..109.5438T. doi:10.1021/jp058004j. PMID 16839071.
- ↑ McMurry, John (2000). Organic Chemistry (5 ed.). Brooks/Cole. p. 818. ISBN 978-0-534-37366-5.
- ↑ Zieborak, K.; Olszewski, K. (1958). Bulletin de l'Academie Polonaise des Sciences-Serie des Sciences Chimiques Geologiques et Geographiques. 6 (2): 3315–3322.
{{cite journal}}: CS1 maint: untitled periodical (ลิงก์) - ↑ 21.0 21.1 Cheung, Hosea; Tanke, Robin S.; Torrence, G. Paul, "Acetic Acid", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a01_045.pub2
- ↑ Fiume, M. Z.; Cosmetic Ingredients Review Expert Panel (June 2003). "Final report on the safety assessment of triacetin". International Journal of Toxicology. 22 (Suppl 2): 1–10. doi:10.1080/747398359. PMID 14555416.
- ↑ Buckingham, J., บ.ก. (1996). Dictionary of Organic Compounds. Vol. 1 (6th ed.). London: Chapman & Hall. ISBN 978-0-412-54090-5.
- ↑ Cheung, Hosea; Tanke, Robin S.; Torrence, G. Paul, "Acetic Acid", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a01_045.pub2
- ↑ Yoneda, N.; Kusano, S.; Yasui, M.; Pujado, P.; Wilcher, S. (2001). "Recent advances in processes and catalysts for the production of acetic acid". Applied Catalysis A: General. 221 (1–2): 253–265. doi:10.1016/S0926-860X(01)00800-6.
- ↑ 26.0 26.1 Roscher, Günter, "VInyl Esters", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a27_419
- ↑ Malveda, Michael; Funada, Chiyo (2003). "Acetic Acid". Chemicals Economic Handbook. SRI International. p. 602.5000. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 14 October 2011.
- ↑ 28.0 28.1 Held, Heimo; Rengstl, Alfred; Mayer, Dieter, "Acetic Anhydride and Mixed Fatty Acid Anhydrides", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a01_065
- ↑ Charlot, G.; Murray, R. G. (1954). Qualitative Inorganic Analysis (4 ed.). CUP Archive. p. 110.
- ↑ Neelakantam, K.; Row, L Ramachangra (1940). "The Lanthanum Nitrate Test for Acetatein Inorganic Qualitative Analysis" (PDF). สืบค้นเมื่อ 5 June 2013.
- ↑ Brantley, L. R.; Cromwell, T. M.; Mead, J. F. (1947). "Detection of acetate ion by the reaction with arsenious oxide to form cacodyl oxide". Journal of Chemical Education. 24 (7): 353. Bibcode:1947JChEd..24..353B. doi:10.1021/ed024p353. ISSN 0021-9584.
- ↑ Malveda, Michael; Funada, Chiyo (2003). "Acetic Acid". Chemicals Economic Handbook. SRI International. p. 602.5000. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 14 October 2011.
แหล่งข้อมูลอื่น
แก้- International Chemical Safety Card 0363
- National Pollutant Inventory – Acetic acid fact sheet
- NIOSH Pocket Guide to Chemical Hazards
- Method for sampling and analysis
- 29 CFR 1910.1000, Table Z-1 (US Permissible exposure limits)
- ChemSub Online: Acetic acid
- Calculation of vapor pressure, liquid density, dynamic liquid viscosity, surface tension of acetic acid
- Acetic acid bound to proteins in the PDB
- Swedish Chemicals Agency. Information sheet – Acetic Acid
- Process Flow sheet of Acetic acid Production by the Carbonylation of Methanol