แอมโมเนีย
แอมโมเนีย (อังกฤษ: ammonia) หรือ ไนโตรเจนไตรไฮไดรด์ เป็นสารประกอบเคมีที่ประกอบด้วยธาตุไนโตรเจนและไฮโดรเจน โดยมีสูตรเคมี ดังนี้ NH3. ที่ STP แอมโมเนียเป็นก๊าซ มันเป็น พิษและกัดกร่อนวัสดุบางชนิด มีกลิ่นฉุนเฉพาะตัว
| |||
| |||
| ชื่อ | |||
|---|---|---|---|
| IUPAC name
Ammonia[1]
| |||
| Systematic IUPAC name
Azane | |||
| ชื่ออื่น
Hydrogen nitride
R-717, R717 (สารทำความเย็น) | |||
| เลขทะเบียน | |||
3D model (JSmol)
|
|||
| 3DMet | |||
| 3587154 | |||
| ChEBI | |||
| ChEMBL | |||
| เคมสไปเดอร์ | |||
| ECHA InfoCard | 100.028.760 | ||
| EC Number |
| ||
| 79 | |||
| KEGG | |||
| MeSH | Ammonia | ||
ผับเคม CID
|
|||
| RTECS number |
| ||
| UNII | |||
| UN number | 1005 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| คุณสมบัติ | |||
| NH3 | |||
| มวลโมเลกุล | 17.031 g/mol | ||
| ลักษณะทางกายภาพ | แก๊สไร้สี | ||
| กลิ่น | กลิ่นฉุนมาก | ||
| ความหนาแน่น | 0.86 kg/m3 (1.013 บาร์ที่จุดเดือด) 0.769 kg/m3 (STP)[2] | ||
| จุดหลอมเหลว | −77.73 องศาเซลเซียส (−107.91 องศาฟาเรนไฮต์; 195.42 เคลวิน) (จุดร่วมสามที่ 6.060 kPa, 195.4 K) | ||
| จุดเดือด | −33.34 องศาเซลเซียส (−28.01 องศาฟาเรนไฮต์; 239.81 เคลวิน) | ||
| จุดวิกฤติ (T, P) | 132.4 องศาเซลเซียส (405.5 เคลวิน), 111.3 บรรยากาศมาตรฐาน (11,280 กิโลปาสกาล) | ||
| 47% w/w (0 °C) 31% w/w (25 °C) 18% w/w (50 °C)[5] | |||
| ความสามารถละลายได้ | ละลายน้ำได้ในคลอโรฟอร์ม, อีเทอร์, เอทานอล, เมทานอล | ||
| ความดันไอ | 857.3 kPa | ||
| pKa | 32.5 (−33 °C),[6] 9,24 (ของแอมโมเนียม) | ||
| Basicity (pKb) | 4.75 | ||
| กรด | แอมโมเนียม | ||
| เบส | Amide | ||
| −18.0·10−6 cm3/mol | |||
ดัชนีหักเหแสง (nD)
|
1.3327 | ||
| ความหนืด |
| ||
| โครงสร้าง | |||
| C3v | |||
| พีระมิดฐานสามเหลี่ยม | |||
| 1.42 D | |||
| อุณหเคมี | |||
Std molar
entropy (S⦵298) |
193 J·mol−1·K−1[8] | ||
Std enthalpy of
formation (ΔfH⦵298) |
−46 kJ·mol−1[8] | ||
| ความอันตราย | |||
| GHS labelling:[10] | |||
   
| |||
| อันตราย | |||
| H280, H314, H331, H410 | |||
| P260, P273, P280, P303+P361+P353, P304+P340+P311, P305+P351+P338+P310 | |||
| NFPA 704 (fire diamond) | |||
| จุดวาบไฟ | 132 องศาเซลเซียส (270 องศาฟาเรนไฮต์; 405 เคลวิน) | ||
| 651 องศาเซลเซียส (1,204 องศาฟาเรนไฮต์; 924 เคลวิน) | |||
| ขีดจำกัดการระเบิด | 15,0–33,6% | ||
| ปริมาณหรือความเข้มข้น (LD, LC): | |||
LD50 (median dose)
|
0.015 mL/kg (มนุษย์, ปาก) | ||
LC50 (median concentration)
|
40,300 ppm (หนู, 10 นาที) 28,595 ppm (หนู, 20 นาที) 20,300 ppm (หนู, 40 นาที) 11,590 ppm (หนู, 1 ชั่วโมง) 7338 ppm (หนู, 1 ชั่วโมง) 4837 ppm (หนูเลี้ยง, 1 ชั่วโมง) 9859 ppm (กระต่าย, 1 ชั่วโมง) 9859 ppm (แมว, 1 ชั่วโมง) 2000 ppm (หนู, 4 ชั่วโมง) 4230 ppm (หนูเลี้ยง, 1 ชั่วโมง)[9] | ||
LCLo (lowest published)
|
5000 ppm (สัตว์เลี้ยงลูกด้วยนม, 5 นาที) 5000 ppm (มนุษย์, 5 นาที)[9] | ||
| NIOSH (US health exposure limits):[11] | |||
PEL (Permissible)
|
50 ppm (25 ppm ACGIH- TLV; 35 ppm STEL) | ||
REL (Recommended)
|
TWA 25 ppm (18 mg/m3) ST 35 ppm (27 mg/m3) | ||
IDLH (Immediate danger)
|
300 ppm | ||
| เอกสารข้อมูลความปลอดภัย (SDS) | ICSC 0414 (anhydrous) | ||
| สารประกอบอื่นที่เกี่ยวข้องกัน | |||
แคทไอออนอื่น ๆ
|
ฟอสฟีน อาร์ซีน Stibine Bismuthine | ||
nitrogen hydridesที่เกี่ยวข้อง
|
ไฮดราซีน กรดไฮดราโซอิก | ||
สารประกอบที่เกี่ยวข้อง
|
แอมโมเนียม ไฮดรอกไซด์ | ||
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |||
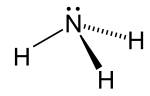
โมเลกุลของแอมโมเนียไม่แบนราบ แต่จะมีลักษณะถูกอัดเป็นทรงสี่หน้า (tetrahedron) หรือเรียกว่าพีระมิดฐานสามเหลี่ยม, ซึ่งเป็นข้อสมมติฐานของทฤษฎี VSEPR รูปร่างโมเลกุลลักษณะนี้โดยรวมจะมีลักษณะเป็นไดโพล (dipole) และทำให้มันเป็นขั้ว ดังนั้นแอมโมเนียจึงละลายใน น้ำ ได้ดีมาก อะตอมไนโตรเจนในโมเลกุลจะมี อิเล็กตรอนคู่โดดเดี่ยว (lone electron pair) และทำให้แอมโมเนียมีฤทธิ์เป็น เบส ใน สารละลายน้ำ (aqueous solution) ที่ เป็นกรด หรือเป็นกลางมันสามารถจะมีพันธะกับ ไฮโดรเนียมไอออน (H3O+) ปลดปล่อยโมเลกุลของน้ำ (H2O) แล้วเกิดเป็นประจุบวกของ แอมโมเนียมไอออน (NH4+) , ซึ่งรูปร่างปกติทรงสี่หน้าที่แอมโมเนียจะเกิด แอมโมเนียมไอออน จะขึ้นอยู่กับ pH ของ สารละลาย
ประโยชน์หลักของแอมโมเนียคือ ใช้ผลิต
- ปุ๋ย (fertilizer)
- วัตถุระเบิด (explosive)
- พอลิเมอร์ (polymer)
นอกจากนี้ยังเป็นสารสำคัญในน้ำยาทำความสะอาดกระจก แอมโมเนียมีในปริมาณเล็กน้อยในบรรยากาศ ซึ่งเกิดจากพูทรีแฟคชัน (putrefaction) ในวัตถุประเภทไนโตรเจนที่เกิดจากพืชและสัตว์ แอมโมเนียและเกลือของมันอาจพบได้ในปริมาณเล็กน้อยในน้ำฝน ในขณะที่ แอมโมเนียมคลอไรด์ (sal-ammoniac) และ แอมโมเนียมซัลเฟต สามารถพบได้ในแหล่งภูเขาไฟ ผลึกของ แอมโมเนียม ไบคาร์บอเนต พบมากใน ปาโกเนียน (Patagonia) กัวโน (guano) เกลือแอมโมเนียมสามารถพบได้ในดินที่มีความอุดมสมบูรณ์ และในน้ำทะเลด้วย (สสารที่มีแอมโมเนียเราเรียกว่าแอมโมเนียคัล)
การเกิดเกลือ (Formation of salts)
แก้หนึ่งในคุณสมบัติเฉพาะตัวที่สุดของแอมโมเนียคือพลังในการทำปฏิกิริยากับ กรด เกิดเป็น เกลือ; เช่น กับ กรดไฮโดรคลอริก ได้เป็น แอมโมเนียมคลอไรด์ (sal-ammoniac) ; กับ กรดไนตริก ได้เป็น แอมโมเนียมไนเตรต, กับกรดซัลฟูริค ได้เป็น แอมโมเนียมซัลเฟต (Mohrs Salt)หรือกับกรดฟอสฟอริก ได้เป็น แอมโมเนียมฟอสเฟต เป็นต้น อย่างไรก็ดีแอมโมเนียที่แห้งสนิทจะไม่ทำปฏิกิริยากับ กรดไฮโดรคลอริกที่แห้งเช่นกัน ความชื้นจำเป็นสำหรับปฏิกิริยา
เกลือที่เกิดจากปฏิกิริยาระหว่างแอมโมเนียกับกรด จะรู้จักกันในชื่อ เกลือแอมโมเนียม และทั้งหมดจะมีแอมโมเนียม ไอออน (NH4+).
ความเป็นกรดของแอมโมเนีย
แก้แม้แอมโมเนียเป็นด่าง มันก็มีฤทธิ์เป็นกรดด้วย แต่เป็นกรดที่อ่อนมาก เมื่อแตกตัวจะได้ อะไมด์ (NH2−) ไอออน, ตัวอย่างเช่น เมื่อใส่ผงลิเทียม ไนไตรต์ลงในแอมโมเนียเหลว จะเกิดเป็น สารละลายลิเทียม อะไมด์ ดังสมการ:
Li3N (s) + 2NH3 (l) → 3Li+ (am) + 3NH2− (am).
ตามหลักปฏิกิริยากรด-ด่างของ บรอนสเตด-โลว์รี (Bronsted-Lowry) แอมโมเนียจะทำหน้าที่เป็นกรด
การผลิต (Production)
แก้เพราะประโยชน์ของมันมีมากมายมหาศาล แอมโมเนียจึงเป็นหนึ่งในสารประกอบอนินทรีย์เคมีที่มีการผลิตมาก โดยมีวิธีการผลิตดังนี้
- ก่อนสงครามโลกครั้งที่ 1 แอมโมเนีย ได้มาจาก การกลั่น ผลผลิตไนโตรเจนจากพืชและสัตว์
- โดยปฏิกิริยารีดักชันของ กรดไนตรัส (nitrous acid) และไนไตรต์ (nitrite) กับนัสเซนต์ไฮโดรเจน (nascent hydrogen)
- โดยการสะลายเกลือแอมโมเนียม (ammonium salts) ด้วย อัลคะไลน์ไฮดรอกไซด์ (alkaline hydroxides) หรือ โดยควิกไลม์ (calcium oxide) เกลือที่ใช้ส่วนใหญ่จะอยู่ในรูปของ คลอไรด์ เช่น ซัล-แอมโมนิแอก ดังสมการนี้
- 2NH4Cl + 2CaO → CaCl2 + Ca (OH) 2 + 2NH3
- ได้จากการสะลายตัวของ แมกนีเซียมไนไตรด์ (magnesium nitride) (Mg3N2) กับน้ำดังสมการ
- Mg3N2 + 6H2O → 3Mg (OH) 2+ 2NH3
- ปัจจุบันผลิตโดย กระบวนการฮาเบอร์ (Haber process) โดยการนำก๊าซ ไนโตรเจน และ ไฮโดรเจน มาผสมกันโดยมีเหล็ก เป็น ตัวเร่งปฏิกิริยา ที่ความดันเท่ากับ 200 bar (20 MPa, 3000 lbf/in²) และอุณหภูมิเท่ากับ 500 °C และมี โมลิบดีนัม เป็น โปรโมเตอร์ (promoter) มีสมการดังนี้
- N2 + 3H2 → 2 NH3
วิธีนี้เป็นวิธีที่ประหยัดที่สุดเพราะ ไนโตรเจน ก็ได้จากอากาศเนื่องจากในอากาศมี ไนโตรเจน ถึง 78 % ส่วน ไฮโดรเจนได้จาก ก๊าซธรรมชาติ (natural gas)
ดูเพิ่ม
แก้อ้างอิง
แก้- ↑ "NOMENCLATURE OF INORGANIC CHEMISTRY IUPAC Recommendations 2005" (PDF).
- ↑ "Gases – Densities". สืบค้นเมื่อ 3 March 2016.
- ↑ Yost, Don M. (2007). "Ammonia and Liquid Ammonia Solutions". Systematic Inorganic Chemistry. READ BOOKS. p. 132. ISBN 978-1-4067-7302-6.
- ↑ Blum, Alexander (1975). "On crystalline character of transparent solid ammonia". Radiation Effects and Defects in Solids. 24 (4): 277. doi:10.1080/00337577508240819.
- ↑ Budavari, Susan, บ.ก. (1996). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (12th ed.). Merck. ISBN 978-0-911910-12-4.
- ↑ Perrin, D. D., Ionisation Constants of Inorganic Acids and Bases in Aqueous Solution; 2nd Ed., Pergamon Press: Oxford, 1982.
- ↑ Iwasaki, Hiroji; Takahashi, Mitsuo (1968). "Studies on the transport properties of fluids at high pressure". The Review of Physical Chemistry of Japan. 38 (1).
- ↑ 8.0 8.1 Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A22. ISBN 978-0-618-94690-7.
- ↑ 9.0 9.1 "Ammonia". Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ↑ Sigma-Aldrich Co., Ammonia.
- ↑ NIOSH Pocket Guide to Chemical Hazards. "#0028". National Institute for Occupational Safety and Health (NIOSH).
ผลงานอ้างอิง
แก้- "Aqua Ammonia". airgasspecialtyproducts.com. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 19 November 2010. สืบค้นเมื่อ 28 November 2010.
- บทความนี้ ประกอบด้วยข้อความจากสิ่งพิมพ์ซึ่งปัจจุบันเป็นสาธารณสมบัติ: Chisholm, Hugh, บ.ก. (1911). . สารานุกรมบริตานิกา ค.ศ. 1911. Vol. 1 (11 ed.). สำนักพิมพ์มหาวิทยาลัยเคมบริดจ์. pp. 861–863.
- Clark, Jim (April 2013) [2002]. "The Haber Process" (ภาษาอังกฤษ). สืบค้นเมื่อ 15 December 2018.
อ่านเพิ่ม
แก้- Bretherick, L., บ.ก. (1986). Hazards in the Chemical Laboratory (4th ed.). London: Royal Society of Chemistry. ISBN 978-0-85186-489-1. OCLC 16985764.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- แม่แบบ:Housecroft1st
- แม่แบบ:RubberBible53rd
แหล่งข้อมูลอื่น
แก้- International Chemical Safety Card 0414 (anhydrous ammonia), ilo.org.
- International Chemical Safety Card 0215 (aqueous solutions), ilo.org.
- CID 222 จากผับเคม
- "Ammoniac et solutions aqueuses" (ภาษาฝรั่งเศส). Institut National de Recherche et de Sécurité. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 11 December 2010.
- Emergency Response to Ammonia Fertilizer Releases (Spills) for the Minnesota Department of Agriculture.ammoniaspills.org
- National Institute for Occupational Safety and Health – Ammonia Page, cdc.gov
- NIOSH Pocket Guide to Chemical Hazards – Ammonia, cdc.gov
- Ammonia, video


