โซเดียมคลอไรด์
บทความนี้อาจต้องการตรวจสอบต้นฉบับ เพราะใช้โปรแกรมแปล คุณสามารถช่วยพัฒนาบทความได้ |
โซเดียมคลอไรด์ (อังกฤษ: Sodium chloride, สูตรเคมี: NaCl) มีชื่อที่เรียกทั่วไปคือ เกลือแกง เป็นสารประกอบเคมี โซเดียมคลอไรด์เป็นเกลือที่มีบทบาทต่อความเค็มของมหาสมุทร และของเหลวภายนอกเซลล์ของสิ่งมีชีวิตหลายเซลล์ เป็นส่วนประกอบหลักในเกลือที่กินได้ ถูกใช้อย่างกว้างขวางในการเป็นเครื่องปรุงรส และใช้ในการถนอมอาหาร
 ผลึกโซเดียมคลอไรด์ในรูปของเกลือหิน
| |
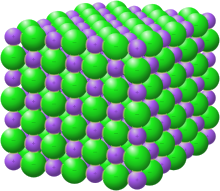 โครงสร้างผลึกที่มีโซเดียมเป็นสีม่วงและคลอไรด์เป็นสีเขียว[1]
| |
| ชื่อ | |
|---|---|
| IUPAC name
Sodium chloride
| |
ชื่ออื่น
| |
| เลขทะเบียน | |
3D model (JSmol)
|
|
| 3534976 | |
| ChEBI | |
| ChEMBL | |
| เคมสไปเดอร์ | |
| ECHA InfoCard | 100.028.726 |
| EC Number |
|
| 13673 | |
| KEGG | |
| MeSH | Sodium+chloride |
ผับเคม CID
|
|
| RTECS number |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| คุณสมบัติ | |
| NaCl | |
| มวลโมเลกุล | 58.443 g/mol[2] |
| ลักษณะทางกายภาพ | ผลึกลูกบาศก์ไม่มีสี[2] |
| กลิ่น | ไม่มีกลิ่น |
| ความหนาแน่น | 2.17 g/cm3[2] |
| จุดหลอมเหลว | 800.7 องศาเซลเซียส (1,473.3 องศาฟาเรนไฮต์; 1,073.8 เคลวิน)[2] |
| จุดเดือด | 1,465 องศาเซลเซียส (2,669 องศาฟาเรนไฮต์; 1,738 เคลวิน)[2] |
| 360 g/L (25°C)[2] | |
| ความสามารถละลายได้ ใน แอมโมเนีย | 21.5 g/L |
| ความสามารถละลายได้ ใน เมทานอล | 14.9 g/L |
| −30.2·10−6 cm3/mol[3] | |
ดัชนีหักเหแสง (nD)
|
1.5441 (at 589 nm)[4] |
| โครงสร้าง[5] | |
| Face-centered cubic (see text), cF8 | |
| Fm3m (No. 225) | |
a = 564.02 pm
| |
หน่วยสูตร (Z)
|
4 |
| octahedral at Na+ octahedral at Cl− | |
| อุณหเคมี[6] | |
ความจุความร้อน (C)
|
50.5 J/(K·mol) |
Std molar
entropy (S⦵298) |
72.10 J/(K·mol) |
Std enthalpy of
formation (ΔfH⦵298) |
−411.120 kJ/mol |
| เภสัชวิทยา | |
| A12CA01 (WHO) B05CB01, B05XA03, S01XA03 | |
| ความอันตราย | |
| NFPA 704 (fire diamond) | |
| ปริมาณหรือความเข้มข้น (LD, LC): | |
LD50 (median dose)
|
3 g/kg (oral, rats)[7] |
| สารประกอบอื่นที่เกี่ยวข้องกัน | |
แอนไอออนอื่น ๆ
|
โซเดียมฟลูออไรด์ โซเดียมโบรไมด์ โซเดียมไอโอไดด์ โซเดียมแอสทาไทด์ |
แคทไอออนอื่น ๆ
|
ลิเทียมคลอไรด์ โพแทสเซียมคลอไรด์ รูบิเดียมคลอไรด์ ซีเซียมคลอไรด์ แฟรนเซียมคลอไรด์ |
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |
โครงสร้างผลึก
แก้สีน้ำเงินอ่อน = Na+
สีเขียวเข้ม = Cl−
โซเดียมคลอไรด์ จะเกิดผลึกแบบคิวบิก ในโครงสร้างของผลึก ไอออนคลอไรด์ซึ่งมีขนาดใหญ่จะถูกจัดเรียงแบบ ccp ในขณะที่โซเดียมไอออนซึ่งมีขนาดเล็กกว่าจะถูกบรรจุในช่องว่าง ออกตะฮีดรัลระหว่างไอออนคลอไรด์ แต่ละไอออนจะถูกล้อมรอบด้วยไอออนอีกชนิด 6 ตัว ซึ่งเป็นโครงสร้างพื้นฐานเดียวกันกับที่พบในแร่อื่นหลายชนิดและรู้จักกันในชื่อ โครงสร้างเกลือหิน
ความสำคัญทางชีววิทยา
แก้โซเดียมคลอไรด์ มีความสำคัญต่อสิ่งมีชีวิตบนโลกในเนื้อเยื้อชีวภาพ และของเหลวในร่างกายจะมีเกลือในปริมาณที่แตกต่างกัน ความเข้มข้นของ โซเดียมไอออนใน เลือด เป็นความสัมพันธ์โดยตรงต่อการควบคุมระดับที่ปลอดภัยของของเหลวในร่างกาย การแพร่กระจายของ การกระตุ้นประสาท โดยซิกนัล ทรานสดักชัน (signal transduction) ถูกควบคุมโดยโซเดียม ไอออน(โพแทสเซียม เป็น โลหะ ที่มีความสัมพันธ์ใกล้ชิดกับโซเดียม ซึ่งเป็นส่วนประกอบหลักในระบบร่างกายเช่นกัน)
0.9% โซเดียมคลอไรด์ ใน น้ำ ถูกเรียกว่า สารละลายทางสรีรวิทยา (physiological solution) หรือ นอร์มัล ซาไลน์ (normal saline) เพราะเป็นความเข้มข้นเดียว (isotonic) กับ พลาสมาในเลือด นอร์มัล ซาไลน์ ใช้ในทางการแพทย์เพื่อทดแทนการสูญเสียของเหลวจากร่างกายและการรักษาแบบนี้ว่าการให้ของเหลวทดแทน (fluid replacement) ซึ่งใช้แพร่หลายทาง การแพทย์ เพื่อป้องกันการขาดน้ำ (dehydration) หรือ อินทราวีนัสเทอราปี (intravenous therapy) เพื่อป้องกัน การช๊อคจากปริมาตรเลือดต่ำ สาเหตุจากการสูญเสียเลือด
มนุษย์ไม่เหมือนสัตว์ ไพรเมต ด้วยกันที่สามารถกำจัดเกลือจำนวนมากได้ทาง เหงื่อ (sweating)
การผลิตและการใช้
แก้ปัจจุบันเกลือถูกผลิตโดย การระเหย ของ น้ำทะเล หรือ น้ำเค็ม (brine) จากแหล่งอื่นๆ เช่น บ่อน้ำเค็ม ทะเลสาบน้ำเค็ม (salt lake) และการทำเหมืองเกลือที่เรียกว่า เกลือหิน (rock salt หรือ เฮไลต์)
ในขณะที่ผู้คนจำนวนมากคุ้นเคยกับการใช้เกลือปรุงอาหารแต่เกลือสามารถใช้ประโยชน์ได้อีกมากมาย เช่น
- ใช้ในการผลิตกระดาษ
- ใช้ในหมึกพิมพ์ผ้าในอุตสาหกรรมเท็กไทล์
- ใช้ในอุตสาหกรรมผลิตสบู่และผงซักฟอก
- ใช้ในการละลายน้ำแข็งที่เกาะบนพื้นถนนในแคนาดาและสหรัฐอเมริกาในช่วงฤดูหนาวที่อุณหภูมิต่ำกว่าจุดเยือกแข็งของน้ำ
- ใช้เป็นวัตถุดิบในการผลิตคลอรีน พีวีซี และยาฆ่าแมลง
| ความสามารถในการละลายของโซเดียมคลอไรด์ในตัวละลายต่างชนิด (g NaCl / 100 g of solvent at 25?C) | |
|---|---|
| H2O | 36 |
| แอมโมเนียเหลว | 3.02 |
| เมทานอล | 1.4 |
| กรดฟอร์มิก | 5.2 |
| ซัลโฟเลน | 0.005 |
| อะซิโตนิไตรล์ | 0.0003 |
| อะซิโตน | 0.000042 |
| ฟอร์มาไมด์ | 9.4 |
| ไดเมทิลฟอร์มาไมด์ | 0.04 |
| Reference: Burgess, J. Metal Ions in Solution (Ellis Horwood, New York, 1978) ISBN 0-85312-027-7 | |
ดูเพิ่มเกลือเสริมไอโอดีน
แก้อ้างอิง
แก้แหล่งอ้างอิง
แก้- Haynes, William M., บ.ก. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
แหล่งข้อมูลอื่น
แก้- Salt United States Geological Survey Statistics and Information
- "Using Salt and Sand for Winter Road Maintenance". Road Management Journal. December 1997. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 21 September 2016. สืบค้นเมื่อ 13 February 2007.
- Calculators: surface tensions เก็บถาวร 2020-02-22 ที่ เวย์แบ็กแมชชีน, and densities, molarities and molalities เก็บถาวร 2020-02-22 ที่ เวย์แบ็กแมชชีน of aqueous NaCl (and other salts)
- JtBaker MSDS
