ริโตนาเวียร์
(เปลี่ยนทางจาก Ritonavir)
ริโตนาเวียร์ (อังกฤษ: Ritonavir) ขายภายใต้เครื่องหมายทางการค้า Norvir เป็นยาต้านรีโทรไวรัสที่ใช้รักษา HIV/AIDS ร่วมกับยาอื่น ๆ[4][3][5] การรักษาแบบผสมผสานมีชื่อเรียกว่า highly active antiretroviral therapy (HAART)[5] นอกจากนี้ยังสามารถใช้ร่วมกับยาอื่นไว้รักษาไวรัสตับอักเสบซี[6] ยานี้บริโภคทางปาก[5]
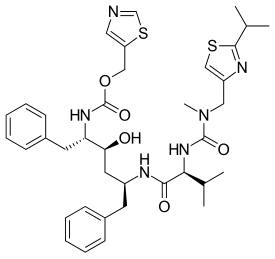 | |
 | |
| ข้อมูลทางคลินิก | |
|---|---|
| ชื่อทางการค้า | Norvir |
| ชื่ออื่น | RTV |
| AHFS/Drugs.com | โมโนกราฟ |
| MedlinePlus | a696029 |
| ข้อมูลทะเบียนยา | |
| ระดับความเสี่ยงต่อทารกในครรภ์ |
|
| ช่องทางการรับยา | ทางปาก |
| รหัส ATC | |
| กฏหมาย | |
| สถานะตามกฏหมาย | |
| ข้อมูลเภสัชจลนศาสตร์ | |
| การจับกับโปรตีน | 98-99% |
| การเปลี่ยนแปลงยา | ตับ |
| ครึ่งชีวิตทางชีวภาพ | 3-5 ชั่วโมง |
| การขับออก | ส่วนใหญ่ในอุจจาระ |
| ตัวบ่งชี้ | |
| |
| เลขทะเบียน CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| NIAID ChemDB | |
| PDB ligand | |
| ECHA InfoCard | 100.125.710 |
| ข้อมูลทางกายภาพและเคมี | |
| สูตร | C37H48N6O5S2 |
| มวลต่อโมล | 720.95 g·mol−1 |
| แบบจำลอง 3D (JSmol) | |
| |
| |
ผลข้างเคียงทั่วไปคือคลื่นไส้, อาเจียน, ไม่มีความอยากอาหาร, ท้องเสีย และมือกับเท้าชา[5] ผลข้างเคียงที่ร้ายแรงได้แก่ ปัญหาที่ตับ, pancreatitis, ภูมิแพ้ และหัวใจเต้นผิดจังหวะ[5] ปฏิสัมพันธ์ที่รุนแรงอาจเกิดขึ้นจากการใช้ยาอื่น เช่น อะมิโอดาโรน และซิมวาสแตติน[5] ผู้ตั้งครรภ์อนุญาตใช้ยาในปริมาณต่ำได้[7]
มีการจดสิทธิบัตรริโตนาเวียใน ค.ศ. 1989 และเริ่มใช้งานในทางการแพทย์ใน ค.ศ. 1996[8][9] โดยมีการบรรจุลงในรายชื่อยาสำคัญขององค์การอนามัยโลก[10]
อ้างอิง
แก้- ↑ "Notice: Nirmatrelvir (COVID-19) added to Prescription Drug List (PDL)". Health Canada. 17 January 2022. เก็บจากแหล่งเดิมเมื่อ May 29, 2022. สืบค้นเมื่อ 25 June 2022.
- ↑ "Norvir Product information". Health Canada. 25 April 2012. สืบค้นเมื่อ 25 June 2022.
- ↑ 3.0 3.1 "Norvir EPAR". European Medicines Agency (EMA). เก็บจากแหล่งเดิมเมื่อ October 2, 2018. สืบค้นเมื่อ August 20, 2020. Text was copied from this source which is © European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- ↑ 4.0 4.1 "Norvir- ritonavir tablet, film coated Norvir- ritonavir solution Norvir- ritonavir powder". DailyMed. เก็บจากแหล่งเดิมเมื่อ November 18, 2021. สืบค้นเมื่อ November 17, 2021.
- ↑ 5.0 5.1 5.2 5.3 5.4 5.5 "Ritonavir". The American Society of Health-System Pharmacists. เก็บจากแหล่งเดิมเมื่อ October 17, 2015. สืบค้นเมื่อ October 23, 2015.
- ↑ "FDA approves Viekira Pak to treat hepatitis C" (Press release). U.S. Food and Drug Administration (FDA). December 19, 2014. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ October 31, 2015.
- ↑ "Ritonavir Pregnancy and Breastfeeding Warnings". drugs.com. เก็บจากแหล่งเดิมเมื่อ September 7, 2015. สืบค้นเมื่อ October 23, 2015.
- ↑ Hacker M (2009). Pharmacology principles and practice. Amsterdam: Academic Press/Elsevier. p. 550. ISBN 9780080919225. เก็บจากแหล่งเดิมเมื่อ June 17, 2020. สืบค้นเมื่อ September 10, 2017.
- ↑ Fischer J, Ganellin CR (2006). Analogue-based Drug Discovery. John Wiley & Sons. p. 509. ISBN 9783527607495. เก็บจากแหล่งเดิมเมื่อ June 20, 2021. สืบค้นเมื่อ August 27, 2020.
- ↑ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
อ่านเพิ่ม
แก้- Chemburkar SR, Bauer J, Deming K, Spiwek H, Patel K, Morris J, และคณะ (2000). "Dealing with the Impact of Ritonavir Polymorphs on the Late Stages of Bulk Drug Process Development". Organic Process Research & Development. 4 (5): 413–417. doi:10.1021/op000023y.
แหล่งข้อมูลอื่น
แก้- "Ritonavir". Drug Information Portal. U.S. National Library of Medicine.