บิวเทน
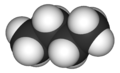
บิวเทน (อังกฤษ: butane) เป็นสารประกอบอินทรีย์ที่มีสูตรเคมี C4H10 ลักษณะเป็นแก๊สไม่มีสี มีกลิ่นคล้ายแก๊สโซลีนหรือแก๊สธรรมชาติ มีความไวไฟสูง คำว่า "บิวเทน" อาจหมายความได้ถึง n-butane หรือ isobutane ซึ่งเป็นไอโซเมอร์กัน แต่ตามหลักการเรียกชื่อของสหภาพเคมีบริสุทธิ์และเคมีประยุกต์ระหว่างประเทศ (IUPAC) บิวเทนจะหมายถึง n-butane เพียงอย่างเดียว บิวเทนมีรากศัพท์มาจากกรดบิวทีริก ซึ่งมาจากคำภาษาละติน butyrum แปลว่าเนย[6] ถูกค้นพบโดยเอดเวิร์ด แฟรงก์แลนด์ในปี ค.ศ. 1849[7] และเอดมันด์ โรนัลส์เป็นคนแรกที่บรรยายถึงคุณสมบัติ[8]
| |||
| |||
| ชื่อ | |||
|---|---|---|---|
| Preferred IUPAC name
Butane[3] | |||
| Systematic IUPAC name
Tetracarbane (never recommended[3]) | |||
| ชื่ออื่น | |||
| เลขทะเบียน | |||
3D model (JSmol)
|
|||
| 969129 | |||
| ChEBI | |||
| ChEMBL | |||
| เคมสไปเดอร์ | |||
| ECHA InfoCard | 100.003.136 | ||
| EC Number |
| ||
| เลขอี | E943a (glazing agents, ...) | ||
| 1148 | |||
| KEGG | |||
| MeSH | butane | ||
ผับเคม CID
|
|||
| RTECS number |
| ||
| UNII | |||
| UN number | 1011 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| คุณสมบัติ | |||
| C4H10 | |||
| มวลโมเลกุล | 58.124 g·mol−1 | ||
| ลักษณะทางกายภาพ | แก๊สไม่มีสี | ||
| กลิ่น | คล้ายแก๊สโซลีนหรือแก๊สธรรมชาติ[1] | ||
| ความหนาแน่น | 2.48 kg/m3 (at 15 องศาเซลเซียส (59 องศาฟาเรนไฮต์)) | ||
| จุดหลอมเหลว | −140 to −134 °C; −220 to −209 °F; 133 to 139 K | ||
| จุดเดือด | −1 to 1 °C; 30 to 34 °F; 272 to 274 K | ||
| 61 mg L−1 (at 20 องศาเซลเซียส (68 องศาฟาเรนไฮต์)) | |||
| log P | 2.745 | ||
| ความดันไอ | ~170 kPa at 283 K [4] | ||
| กรด | Butanium | ||
| -57.4·10−6 cm3/mol | |||
| อุณหเคมี | |||
ความจุความร้อน (C)
|
98.49 J K−1 mol−1 | ||
Std enthalpy of
formation (ΔfH⦵298) |
−126.3–−124.9 kJ mol−1 | ||
Std enthalpy of
combustion (ΔcH⦵298) |
−2.8781–−2.8769 MJ mol−1 | ||
| ความอันตราย[5] | |||
| GHS labelling: | |||

| |||
| อันตราย | |||
| H220 | |||
| P210 | |||
| NFPA 704 (fire diamond) | |||
| จุดวาบไฟ | −60 องศาเซลเซียส (−76 องศาฟาเรนไฮต์; 213 เคลวิน) | ||
| 405 องศาเซลเซียส (761 องศาฟาเรนไฮต์; 678 เคลวิน) | |||
| ขีดจำกัดการระเบิด | 1.8–8.4% | ||
| NIOSH (US health exposure limits): | |||
PEL (Permissible)
|
none[1] | ||
REL (Recommended)
|
TWA 800 ppm (1900 mg/m3)[1] | ||
IDLH (Immediate danger)
|
N.D.[1] | ||
| สารประกอบอื่นที่เกี่ยวข้องกัน | |||
alkanesที่เกี่ยวข้อง
|
|||
สารประกอบที่เกี่ยวข้อง
|
Perfluorobutane | ||
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |||
บิวเทนเป็นสารไฮโดรคาร์บอนชนิดแอลเคนที่มีคาร์บอน 4 อะตอมเชื่อมต่อกันด้วยพันธะเดี่ยว บิวเทนมี 2 ไอโซเมอร์ได้แก่ n-butane และ isobutane ซึ่งทั้งสองมีสูตรเคมีเหมือนกันแต่ต่างกันที่โครงสร้าง โดย n-butane มีโครงสร้างแบบไม่มีกิ่ง ในขณะที่ isobutane เป็นโครงสร้างแบบมีกิ่ง โครงสร้างที่แตกต่างกันนี้ส่งผลให้สองไอโซเมอร์นี้มีจุดเดือดต่างกัน โดย n-butane มีจุดเดือดสูงกว่าอันเป็นผลมาจากการมีพื้นที่ผิวสัมผัสระหว่างโมเลกุลมากกว่า ส่งผลให้มีแรงระหว่างโมเลกุลมากเช่นกัน[9][10] บิวเทนเป็นหนึ่งในสารที่พบในน้ำมันดิบและแก๊สธรรมชาติ และเป็นสารกลุ่มแรก ๆ ที่ถูกแยกออกเมื่อมีการกลั่นลำดับส่วนเนื่องจากมีจุดเดือดต่ำกว่าสารชนิดอื่น[11] เมื่อเผาบิวเทนในที่ที่มีออกซิเจนมากจะได้ผลิตภัณฑ์เป็นคาร์บอนไดออกไซด์และไอน้ำ แต่หากมีออกซิเจนไม่เพียงพอจะได้คาร์บอนมอนอกไซด์หรือเขม่าคาร์บอน ดังสมการ
เมื่อมีออกซิเจนเพียงพอ:
- 2 C4H10 + 13 O2 → 8 CO2 + 10 H2O
เมื่อมีออกซิเจนไม่เพียงพอ:
- 2 C4H10 + 9 O2 → 8 CO + 10 H2O
บิวเทนใช้ผสมกับแก๊สโซลีนเป็นน้ำมันเชื้อเพลิงและใช้เพิ่มเลขออกเทนในน้ำมันเบนซิน เมื่อผสมกับโพรเพนและสารไฮโดรคาร์บอนอื่น ๆ จะได้แก๊สปิโตรเลียมเหลว (LPG) หรือแก๊สหุงต้ม นอกจากนี้ยังใช้เป็นเชื้อเพลิงของไฟแช็ก เครื่องพ่นไฟสำหรับทำอาหารและสารขับดันสำหรับกระป๋องสเปรย์ เมื่อใช้เป็นแก๊สสำหรับบรรจุภัณฑ์จะมีเลขอีคือ E943a[12] บิวเทนบริสุทธิ์โดยเฉพาะ isobutane ใช้เป็นสารทำความเย็นแทนฮาโลมีเทนที่ทำลายชั้นโอโซน บิวเทนเป็นสารระเหยที่เมื่อสูดดมเข้าไปจะก่อให้เกิดภาวะเคลิ้มสุข ง่วงซึม หัวใจเต้นผิดจังหวะ ความดันโลหิตผิดปกติ หมดสติ และอาจเสียชีวิตจากภาวะขาดอากาศหายใจและเว็นทริคูลาร์ ฟิบริลเลชัน[13]
อ้างอิง
แก้- ↑ 1.0 1.1 1.2 1.3 1.4 NIOSH Pocket Guide to Chemical Hazards. "#0068". National Institute for Occupational Safety and Health (NIOSH).
- ↑ Hofmann, August Wilhelm Von (1 January 1867). "I. On the action of trichloride of phosphorus on the salts of the aromatic monamines". Proceedings of the Royal Society of London. 15: 54–62. doi:10.1098/rspl.1866.0018. สืบค้นเมื่อ 20 September 2018 – โดยทาง rspl.royalsocietypublishing.org.
- ↑ 3.0 3.1 "Front Matter". Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 4. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
Similarly, the retained names ‘ethane’, ‘propane’, and ‘butane’ were never replaced by systematic names ‘dicarbane’, ‘tricarbane’, and ‘tetracarbane’ as recommended for analogues of silane, ‘disilane’; phosphane, ‘triphosphane’; and sulfane, ‘tetrasulfane’.
- ↑ W. B. Kay (1940). "Pressure-Volume-Temperature Relations for n-Butane". Industrial & Engineering Chemistry. 32 (3): 358–360. doi:10.1021/ie50363a016.
- ↑ "Safety Data Sheet, Material Name: N-Butane" (PDF). USA: Matheson Tri-Gas Incorporated. 5 February 2011. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 1 October 2011. สืบค้นเมื่อ 11 December 2011.
- ↑ "butane". Online Etymology Dictionary. สืบค้นเมื่อ December 6, 2019.
- ↑ "Occ paper" (PDF). www.chem.qmul.ac.uk. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2017-04-17. สืบค้นเมื่อ 2019-12-06.
- ↑ Watts, H. (1868). Dictionary of Chemistry. Vol. 4. p. 385.
- ↑ "Intermolecular bonding - van der Waals forces". Chemguide. สืบค้นเมื่อ December 6, 2019.
- ↑ Hofmann, Andreas (2018). Physical Chemistry Essentials. Berlin, Germany: Springer. p. 476. ISBN 9783319741673.
- ↑ Shelley, Craig H.; Cole, Anthony R.; Markley, Timothy E. (2007). Industrial Firefighting for Municipal Firefighters. Tulsa, Oklahoma, US: Fire Engineering Books. p. 107–108. ISBN 9781593700812.
- ↑ Liu, Dongyou (2018). Handbook of Foodborne Diseases. Boca Raton, Florida, US: CRC Press. ISBN 9781351863483.
- ↑ "Butane". New World Encyclopedia. December 22, 2016. สืบค้นเมื่อ December 6, 2019.