แบตเตอรี่
แบตเตอรี่ (อังกฤษ: battery) เป็นอุปกรณ์ที่ประกอบด้วย เซลล์ไฟฟ้าเคมี หนึ่งเซลล์หรือมากกว่า ที่มีการเชื่อมต่อภายนอกเพื่อให้กำลังงานกับอุปกรณ์ไฟฟ้า[1] แบตเตอรี่มี ขั้วบวก (อังกฤษ: anode) และ ขั้วลบ (อังกฤษ: cathode) ขั้วที่มีเครื่องหมายบวกจะมีพลังงานศักย์ไฟฟ้าสูงกว่าขั้วที่มีเครื่องหมายลบ ขั้วที่มีเครื่องหมายลบคือแหล่งที่มาของอิเล็กตรอนที่เมื่อเชื่อมต่อกับวงจรภายนอกแล้วอิเล็กตรอนเหล่านี้จะไหลและส่งมอบพลังงานให้กับอุปกรณ์ภายนอก เมื่อแบตเตอรี่เชื่อมต่อกับวงจรภายนอก สาร อิเล็กโทรไลต์ มีความสามารถที่จะเคลื่อนที่โดยทำตัวเป็นไอออน ยอมให้ปฏิกิริยาทางเคมีทำงานแล้วเสร็จในขั้วไฟฟ้าที่อยู่ห่างกัน เป็นการส่งมอบพลังงานให้กับวงจรภายนอก การเคลื่อนไหวของไอออนเหล่านั้นที่อยู่ในแบตเตอรี่ที่ทำให้เกิดกระแสไหลออกจากแบตเตอรี่เพื่อปฏิบัติงาน[2] ในอดีตคำว่า "แบตเตอรี่" หมายถึงเฉพาะอุปกรณ์ที่ประกอบด้วยเซลล์หลายเซลล์ แต่การใช้งานได้มีการพัฒนาให้รวมถึงอุปกรณ์ที่ประกอบด้วยเซลล์เพียงเซลล์เดียว[3]
 รูปร่างของแบตเตอรี่แบบต่าง ๆ (บนซ้ายจนถึงล่างขวา) แบตเตอรี่แบบ AA 2 หน่วย, แบตเตอรี่แบบ D 1 หน่วย, แบตเตอรี่แบบหูหิ้ว 1 หน่วย, แบตเตอรี่แบบ 9 โวลท์ (PP3) 2 หน่วย, แบตเตอรี่แบบ AAA 2 หน่วย, แบตเตอรี่แบบ C 1 หน่วย, แบตเตอรี่ที่ใช้กับกล้องถ่ายวีดิโอ 1 หน่วย, แบตเตอรี่แบบใช้กับโทรศัพท์ในบ้าน 1 หน่วย | |
| ชนิด | แหล่งจ่ายไฟ |
|---|---|
| หลักการทำงาน | ปฏิกิริยาไฟฟ้าเคมี, แรงเคลื่อนไฟฟ้า |
| ผลิตครั้งแรก | ทศวรรษที่ 1800 |
| สัญลักษณ์ | |
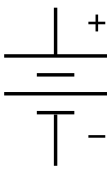 สัญลักษณ์แบบอิเล็กทรอนิกส์สำหรับแบตเตอรี่ในแผนภาพวงจร | |
แบตเตอรี่ปฐมภูมิจะถูกใช้เพียงครั้งเดียวหรือ "ใช้แล้วทิ้ง"; วัสดุที่ใช้ทำขั้วไฟฟ้าจะมีการเปลี่ยนแปลงอย่างถาวรในช่วงปล่อยประจุออก (อังกฤษ: discharge) ตัวอย่างที่พบบ่อยก็คือ แบตเตอรี่อัลคาไลน์ ที่ใช้สำหรับ ไฟฉาย และอีกหลายอุปกรณ์พกพา แบตเตอรี่ทุติยภูมิ (แบตเตอรี่ประจุใหม่ได้) สามารถดิสชาร์จและชาร์จใหม่ได้หลายครั้ง ในการนี้องค์ประกอบเดิมของขั้วไฟฟ้าสามารถเรียกคืนสภาพเดิมได้โดยกระแสย้อนกลับ ตัวอย่างเช่น แบตเตอรี่ตะกั่วกรด ที่ใช้ในยานพาหนะและแบตเตอรี่ ลิเธียมไอออน ที่ใช้สำหรับอุปกรณ์อิเล็กทรอนิกส์แบบเคลื่อนย้ายได้
แบตเตอรี่มาในหลายรูปทรงและหลายขนาด จากเซลล์ขนาดเล็กที่ให้พลังงานกับ เครื่องช่วยฟัง และนาฬิกาข้อมือ จนถึงแบตเตอรี่แบงค์ที่มีขนาดเท่าห้องที่ให้พลังงานเตรียมพร้อมสำหรับ ชุมสายโทรศัพท์ และ ศูนย์ข้อมูล คอมพิวเตอร์
ตามการคาดการณ์ในปี 2005 อุตสาหกรรมแบตเตอรี่ทั่วโลกสร้างมูลค่า 48 พันล้านดอลาร์สหรัฐในการขายในแต่ละปี[4] ด้วยการเจริญเติบโตประจำปี 6%
แบตเตอรี่มีค่า พลังงานเฉพาะ (พลังงานต่อหน่วยมวล) ต่ำกว่ามากเมื่อเทียบกับ เชื้อเพลิง ทั้งหลาย เช่นน้ำมัน แต่ก็สามารถชดเชยได้บ้างโดยประสิทธิภาพที่สูงของมอเตอร์ไฟฟ้าในการผลิตงานด้านกลไกเมื่อเทียบกับเครื่องยนต์สันดาป
ประวัติ แก้
บทความหลัก: ประวัติความเป็นมาของแบตเตอรี่
การใช้ "แบตเตอรี่" เพื่ออธิบายกลุ่มของอุปกรณ์ไฟฟ้าสามารถย้อนหลังไปในสมัย เบนจาอัฟ แฟรงคลิน ผู้ซึ่งในปี 1748 ได้อธิบายกลุ่มของ หม้อเลย์เดน โดยอุปมาว่าเป็น แบตเตอรี่ของปืนใหญ่[5] (เบนจามิน แฟรงคลิน ยืมคำว่า "แบตเตอรี่" จากกองทัพที่หมายถึงอาวุธที่ทำงานด้วยกัน[6])
อาเลสซานโดร โวลตา ได้สร้างและได้อธิบายแบตเตอรี่ไฟฟ้าเคมีตัวแรก voltaic pile ในปี 1800.[7] นี่เป็นชั้นซ้อนกันของแผ่นทองแดงและแผ่นสังกะสี คั่นโดยจานกระดาษชุ่มด้วยน้ำเกลือ มันสามารถผลิตกระแสที่คงที่ได้เป็นเวลานานทีเดียว โวลตาไม่ได้พอใจที่โวลเตจเกิดจากปฏิกิริยาเคมี เขาคิดว่าเซลล์ของเขาเป็นแหล่งพลังงานที่ใช้ไม่หมด[8] และการกัดกร่อนที่กระทบต่อขั้วไฟฟ้าทั้งสองเป็นเพียงสิ่งรบกวน มากกว่าจะเป็นผลตามมาที่ไม่อาจเลี่ยงได้ของการปฏิบัติงานของพวกมัน อย่างที่ ไมเคิล ฟาราเดย์ แสดงให้เห็นในปี 1834.[9]
แม้ว่าแบตเตอรี่ในช่วงต้นต้นจะมีประโยชน์อย่างมากสำหรับวัตถุประสงค์ด้านการทดลองก็ตาม แต่ในทางปฏิบัติแล้วแรงดันไฟฟ้าของพวกมันมีความผันผวนและพวกมันก็ไม่สามารถให้กระแสขนาดใหญ่ได้เป็นระยะเวลาอย่างต่อเนื่อง ส่วน เซลล์ของนีลล์ ที่คิดค้นได้ในปี 1836 โดยนักเคมีชาวอังกฤษ จอห์น เฟรเดอริก นีลล์ เป็นแหล่งผลิตไฟฟ้าในทางปฏิบัติครั้งแรก และกลายเป็นมาตรฐานอุตสาหกรรมและได้รับการยอมรับอย่างกว้างขวางว่าเป็นแหล่งพลังงานสำหรับเครือข่าย โทรเลขไฟฟ้า[10] เซลล์ของนีลล์ประกอบด้วยหม้อทองแดงที่เติมเต็มด้วยสารละลาย คอปเปอร์ซัลเฟต ที่แช่ด้วยภาชนะ ดินเผา เคลือบที่เติมเต็มด้วย กรดกำมะถัน และขั้วไฟฟ้าสังกะสี[11]
เซลล์เปียกเหล่านี้ใช้อิเล็กโทรไลต์เป็นของเหลว ซึ่งมีแนวโน้มที่จะรั่วไหลและหกหากไม่ถือไปมาอย่างถูกต้อง หลายเซลล์ใช้โหลแก้วเพื่อยึดชิ้นส่วนของพวกมันไว้ ซึ่งทำให้พวกมันเปราะบาง ลักษณะเหล่านี้ทำให้เซลล์เปียกไม่เหมาะสมสำหรับการใช้ที่ต้องเคลื่อนย้ายไปมา เมื่อใกล้จุดสิ้นสุดของศตวรรษที่สิบเก้า การประดิษฐ์ขึ้นของ แบตเตอรี่เซลล์แห้ง ซึ่งได้แทนที่อิเล็กโทรไลต์ของเหลวด้วยสารที่เป็นของแข็งกว่า ทำให้อุปกรณ์ไฟฟ้าแบบพกพาสามารถทำได้ในทางปฏิบัติ[12]
หลักการทำงาน แก้
บทความหลัก: เซลล์ไฟฟ้าเคมี
แบตเตอรี่แปลงพลังงานเคมีให้เป็นพลังงานไฟฟ้าโดยตรง แบตเตอรี่ประกอบด้วยเซลล์แบบโวลตาได้มากกว่าหนึ่งเซลล์ แต่ละเซลล์ประกอบด้วยสอง ครึ่งเซลล์ ที่เชื่อมต่อเรียงกันเป็นแถวโดยสารอิเล็กโทรไลต์ที่เป็นสื่อกระแสไฟฟ้าที่มีไอออนที่มีประจุลบ (อังกฤษ: anion) และไอออนที่มีประจุบวก (อังกฤษ: cation) ครึ่งเซลล์หนึ่งตัวจะมีอิเล็กโทรไลต์และขั้วลบ (อิเล็กโทรดที่แอนไอออนวิ่งเข้าหา); อีกครึ่งเซลล์หนึ่งจะมีอิเล็กโทรไลต์และขั้วบวก (อิเล็กโทรดที่แคทไอออนวิ่งเข้าหา Redox ปฏิกิริยา Redox เป็นตัวให้พลังงานกับแบตเตอรี่ แคทไอออนจะลดลง (อิเล็กตรอนมีการเพิ่ม) ที่แคโทดระหว่างการชาร์จประจุ ในขณะที่แอนไอออนจะถูกออกซิไดซ์ (อิเล็กตรอนจะถูกลบออก) ที่ขั้วบวกระหว่างการชาร์จ[13] ในระหว่างการดีสชาร์จกระบวนการจะเป็นตรงกันข้าม ขั้วไฟฟ้าทั้งสองไม่ได้สัมผัสกัน แต่เชื่อมต่อทางไฟฟ้าโดย อิเล็กโทรไลต์ เซลล์บางตัวใช้อิเล็กโทรไลต์แตกต่างกันสำหรับแต่ละครึ่งเซลล์ ตัวคั่นช่วยให้ไอออนไหลระหว่างครึ่งเซลล์ แต่จะช่วยป้องกันการผสมของอิเล็กโทรไลต์ทั้งสองด้าน
แต่ละครึ่งเซลล์มี แรงเคลื่อนไฟฟ้า (หรือ EMF) ที่กำหนดโดยความสามารถของมันในการขับกระแสไฟฟ้าจากภายในสู่ภายนอกของเซลล์ แรงเคลื่อนไฟฟ้าสุทธิของเซลล์คือความแตกต่างระหว่าง EMFs ของครึ่งเซลล์ของมัน[14] ดังนั้นหากขั้วไฟฟ้ามี EMFs = และ ดังนั้น EMF สุทธิจะเป็น ; พูดอีกอย่าง EMF สุทธิคือความแตกต่างระหว่าง Reduction potential ของ ครึ่งปฏิกิริยา[15]
แรงขับไฟฟ้าหรือ ที่ตกคร่อม ขั้ว ของเซลล์เรียกว่า แรงดันไฟฟ้า (แตกต่าง) ที่ขั้ว และถูกวัดเป็น โวลต์[16] แรงดันไฟฟ้าที่ขั้วของเซลล์ที่ไม่ใช่ทั้งกำลังชาร์จและดีสชาร์จเรียกว่า แรงดันไฟฟ้าวงจรเปิด และเท่ากับ emf ของเซลล์. ผลจากความต้านทานภายใน[17] แรงดันไฟฟ้าที่ขั้วของเซลล์ที่กำลังดีสชาร์จจึงมีขนาดเล็กกว่าแรงดันไฟฟ้าวงจรเปิด และแรงดันไฟฟ้าที่ขั้วของเซลล์ที่กำลังชาร์จก็จะมีมากเกินแรงดันไฟฟ้าวงจรเปิด[18]
เซลล์ในอุดมคติจะมีความต้านทานภายในเล็กน้อยจนตัดทิ้งได้ ดังนั้นมันจึงจะรักษาระดับแรงดันที่ขั้วให้มีค่าคงที่ที่เท่ากับ จนหมดแรง แล้วลดลงไปอยู่ที่ศูนย์ ถ้าเซลล์ดังกล่าวสามารถรักษาระดับไว้ที่ 1.5 โวลต์และจัดเก็บประจุจำนวนหนึ่ง คูลอมบ์ จากนั้นเมื่อมันดีสชาร์จอย่างสมบูรณ์ มันควรจะทำงานได้ 1.5 จูล[16] ในเซลล์ปกติ ความต้านทานภายในจะเพิ่มระหว่างการดีสชาร์จ[17] และแรงดันไฟฟ้าวงจรเปิดก็จะลดลงด้วยระหว่างการดีสชาร์จ ถ้าแรงดันไฟฟ้าและความต้านทานถูกวาดเป็นกราฟกับแกนเวลา รูปกราฟที่ได้มักจะเป็นเส้นโค้ง; รูปร่างของเส้นโค้งจะแปรไปตามคุณสมบัติทางเคมีและการจัดแจงภายใน
แรงดันไฟฟ้าที่พัฒนาขึ้นระหว่างขั้วไฟฟ้าของเซลล์จะขึ้นอยู่กับการปลดปล่อยพลังงานของปฏิกิริยาเคมีของขั้วไฟฟ้าและอิเล็กโทรไลต์ของมัน เซลล์แบบ อัลคาไลน์ และแบบ สังกะสีคาร์บอน มีปฏิกิริยาเคมีแตกต่างกัน แต่มี EMF ประมาณเดียวกันที่ 1.5 โวลต์; ในทำนองเดียวกัน เซลล์แบบ NiCd และแบบ NiMH จะมีเคมีที่แตกต่างกัน แต่มี EMF ประมาณเดียวกันที่ 1.2 โวลต์[19] การเปลี่ยนแปลงศักย์ไฟฟ้าเคมีที่สูงในปฏิกิริยาของสารประกอบ ลิเธียม จะเป็นผลให้เซลล์ลิเธียมมี EMF ที่ 3 โวลต์หรือมากกว่า[20]
ประเภทแบตเตอรี่สามัญ แก้
แบตเตอรี่ชนิดประจุไฟฟ้าใหม่ได้ และชนิดใช้แล้วทิ้ง แก้
จากมุมมองของผู้ใช้แบตเตอรี่แบ่งออกเป็น 2 กลุ่มใหญ่ๆ ดังนี้; แบตเตอรี่ชนิดประจุไฟฟ้าใหม่ได้ และ แบตเตอรี่ชนิดประจุไฟฟ้าใหม่ไม่ได้ (ใช้แล้วทิ้ง) ซึ่งนิยมใช้อย่างแพร่หลายทั้งสองชนิด
แบตเตอรี่ใช้แล้วทิ้งเรียกอีกอย่างว่า เซลล์ปฐมภูมิ ใช้ได้ครั้งเดียว เนื่องจากไฟฟ้าที่ได้เกิดจากการเปลี่ยนแปลงของสารเคมีเมื่อสารเคมีเปลี่ยนแปลงหมดไฟฟ้าก็จะหมดจากแบตเตอรี่ แบตเตอรี่เหล่านี้เหมาะสำหรับใช้ในอุปกรณ์ขนาดเล็กและสามารถเคลื่อนย้ายได้สะดวก ใช้ไฟน้อยหรือในที่ที่ห่างไกลจากพลังงานไฟฟ้ากระแสสลับ
ในทางตรงกันข้ามแบตเตอรี่ชนิดประจุไฟฟ้าใหม่ได้หรือ เซลล์ทุติยภูมิ สามารถประจุไฟฟ้าใหม่ได้หลังจากไฟหมดเนื่องจากสารเคมีที่ใช้ทำแบตเตอรี่ชนิดนี้สามารถทำให้กลับไปอยู่ในสภาพเดิมได้โดยการประจุไฟฟ้าเข้าไปใหม่ซึ่งอุปกรณ์ที่ใช้อัดไฟนี้เรียกว่า ชาร์เจอร์ หรือ รีชาร์เจอร์
แบตเตอรี่ชนิดประจุไฟฟ้าใหม่ได้ที่เก่าแก่ที่สุดซึ่งใช้อยู่จนกระทั่งปัจจุบันคือ "เซลล์เปียก" หรือแบตเตอรี่ตะกั่ว-กรด (lead-acid battery) แบตเตอรี่ชนิดนี้จะบรรจุในภาชนะที่ไม่ได้ปิดผนึก (unsealed container) ซึ่งแบตเตอรี่จะต้องอยู่ในตำแหน่งตั้งตลอดเวลาและต้องเป็นพื้นที่ที่ระบายอากาศได้เป็นอย่างดี เพื่อระบายก๊าซ ไฮโดรเจน ที่เกิดจากปฏิกิริยาและแบตเตอรี่ชนิดจะมีน้ำหนักมาก
รูปแบบสามัญของแบตเตอรี่ตะกั่ว-กรด คือแบตเตอรี่ รถยนต์ ซึ่งสามารถจะให้พลังงานไฟฟ้าได้ถึงประมาณ 10,000 วัตต์ในช่วงเวลาสั้น ๆ และมีกระแสตั้งแต่ 450 ถึง 1100 แอมแปร์ สารละลายอิเล็กโตรไลต์ของแบตเตอรี่คือ กรดซัลฟิวริก ซึ่งสามารถเป็นอันตรายต่อผิวหนังและตาได้ แบตเตอรี่ตะกั่ว-กรดที่มีราคาแพงมากเรียกว่า แบตเตอรี่เจล (หรือ "เจลเซลล์") ภายในจะบรรจุอิเล็กโตรไลต์ประเภทเซมิ-โซลิด (semi-solid electrolyte) ที่ป้องกันการหกได้ดี และแบตเตอรี่ชนิดอัดไฟใหม่ได้ที่เคลื่อนย้ายได้สะดวกกว่าคือประเภท "เซลล์แห้ง" ที่นิยมใช้กันในโทรศัพท์มือถือและคอมพิวเตอร์โน้ตบุ๊ก เซลล์ของแบตเตอรี่ชนิดนี้คือ
- นิเกิล-แคดเมียม (NiCd)
- นิเกิลเมตทัลไฮไดรด์ (NiMH)
- ลิเธียม-ไอออน (Li-Ion)
(Primary cell) ใช้แล้วทิ้ง แก้
- Zinc-carbon battery
- Alkaline battery
- Silver-oxide battery
- Lithium battery
- Mercury battery
- Zinc-air battery
ชาร์จใหม่ได้ แก้
ดูเพิ่ม แก้
อ้างอิง แก้
- ↑ Crompton, T. R. (2000-03-20). Battery Reference Book (third ed.). Newnes. p. Glossary 3. ISBN 0080499953. สืบค้นเมื่อ 2016-03-18.
- ↑ "Battery - Definition of battery by Merriam-Webster". merriam-webster.com.
- ↑ Pistoia, Gianfranco (2005-01-25). Batteries for Portable Devices. Elsevier. p. 1. ISBN 0080455565. สืบค้นเมื่อ 2016-03-18.
- ↑ Power Shift: DFJ on the lookout for more power source investments เก็บถาวร 2005-12-01 ที่ เวย์แบ็กแมชชีน.Draper Fisher Jurvetson. Retrieved 20 November 2005.
- ↑ Bellis, Mary. History of the Electric Battery[ลิงก์เสีย]. About.com. Retrieved 11 August 2008.
- ↑ National Geographic Society. "Quiz: What You Don't Know About Batteries". National Geographic.
- ↑ Bellis, Mary. Alessandro Volta – Biography of Alessandro Volta – Stored Electricity and the First Battery เก็บถาวร 2020-02-18 ที่ เวย์แบ็กแมชชีน. About.com. Retrieved 7 August 2008.
- ↑ Stinner, Arthur. Alessandro Volta and Luigi Galvani เก็บถาวร 2008-09-10 ที่ เวย์แบ็กแมชชีน (PDF). Retrieved 11 August 2008.
- ↑ Electric Battery History – Invention of the Electric Battery. The Great Idea Finder. Retrieved 11 August 2008.
- ↑ Battery History, Technology, Applications and Development. MPower Solutions Ltd. Retrieved 19 March 2007.
- ↑ Borvon, Gérard (10 September 2012). "History of the electrical units". Association S-EAU-S.
- ↑ "Columbia Dry Cell Battery". National Historic Chemical Landmarks. American Chemical Society. สืบค้นเมื่อ 25 March 2013.
- ↑ Dingrando 665.
- ↑ Saslow 338.
- ↑ Dingrando 666.
- ↑ 16.0 16.1 Knight 943.
- ↑ 17.0 17.1 Knight 976.
- ↑ Terminal Voltage – Tiscali Reference เก็บถาวร 2008-04-11 ที่ เวย์แบ็กแมชชีน. Originally from Hutchinson Encyclopaedia. Retrieved 7 April 2007.
- ↑ Dingrando 674.
- ↑ Dingrando 677.