ผลต่างระหว่างรุ่นของ "ไอโซโพรพานอล"
หน้าใหม่: {{chembox | Watchedfields = changed | verifiedrevid = 477002700 | Name = Isopropyl alcohol | ImageFileL1 = 2-Propanol.svg | ImageNameL1 = Skeletal formula of isopropy... |
(ไม่แตกต่าง)
|
รุ่นแก้ไขเมื่อ 05:37, 5 มีนาคม 2558
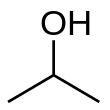
ไอโซโพรพานอล (Isopropanol) หรือ ไอโซโพรพิลแอลกอฮอล์ (Isopropyl alcohol) หรือ 2-โพรพานอล (2-Propanol) หรือโพรพาน-2-ออล (Propan-2-ol) เป็นแอลกอฮอล์ชนิดหนึ่งซึ่งนิยมใช้เป็นสารฆ่าเชื้อในทางการแพทย์ มักใช้ผสมกับอะซีโทนหรือน้ำกลั่นโดยให้แอลกอฮอล์มีปริมาณ 70% โดยปริมาตร เป็นของเหลวใสไม่มีสี กลิ่นรุนแรง และเป็นไอโซเมอร์โครงสร้างกับ1-โพรพานอล จะต่างกันตรงที่มีหมู่ไฮดรอกซิล ต่อที่คาร์บอนตัวที่สองแทนที่จะเป็นปลาย
| |||
| ชื่อ | |||
|---|---|---|---|
| IUPAC name
isopropyl alcohol
| |||
| Preferred IUPAC name
2-Propanol | |||
| ชื่ออื่น
Propan-2-ol; Isopropanol; แอลกอฮอล์เช็ดแผล; sec-Propyl alcohol; s-Propanol; iPrOH; IPA
| |||
| เลขทะเบียน | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| เคมสไปเดอร์ | |||
| ECHA InfoCard | 100.000.601 | ||
| KEGG | |||
ผับเคม CID
|
|||
| RTECS number |
| ||
| UNII | |||
| UN number | 1219 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| คุณสมบัติ | |||
| C3H8O | |||
| มวลโมเลกุล | 60.096 g·mol−1 | ||
| ลักษณะทางกายภาพ | Colorless liquid | ||
| ความหนาแน่น | 0.786 g/cm3 (20 °C) | ||
| จุดหลอมเหลว | −89 องศาเซลเซียส (−128 องศาฟาเรนไฮต์; 184 เคลวิน) | ||
| จุดเดือด | 82.6 องศาเซลเซียส (180.7 องศาฟาเรนไฮต์; 355.8 เคลวิน) | ||
| miscible | |||
| ความสามารถละลายได้ | ผสมกับ เบนซีน คลอโรฟอร์ม เอทานอล อีเทอร์ กลีเซอริน แล้วเข้ากันได้ ละลายได้ในอะซีโทน ไม่ละลายในสารละลายไอออนิก | ||
| pKa | 16.5[1] | ||
ดัชนีหักเหแสง (nD)
|
1.3776 | ||
| ความหนืด | 2.86 cP at 15 °C 1.96 cP at 25 °C[2] 1.77 cP at 30 °C[2] | ||
| 1.66 D (gas) | |||
| ความอันตราย | |||
| อาชีวอนามัยและความปลอดภัย (OHS/OSH): | |||
อันตรายหลัก
|
Flammable | ||
| GHS labelling: | |||
 
| |||
| อันตราย | |||
| H225, H319, H336 | |||
| P210, P261, P305+P351+P338 | |||
| NFPA 704 (fire diamond) | |||
| จุดวาบไฟ | Open cup: 11.7 องศาเซลเซียส (53.1 องศาฟาเรนไฮต์) Closed cup: 13 องศาเซลเซียส (55 องศาฟาเรนไฮต์) | ||
| ขีดจำกัดการระเบิด | 2–12.7% | ||
ค่าขีดจำกัดเกณฑ์ (TLV)
|
980 mg/m3 (TWA), 1225 mg/m3 (STEL) | ||
| ปริมาณหรือความเข้มข้น (LD, LC): | |||
LD50 (median dose)
|
3600 mg/kg (oral, mouse) 12800 mg/kg (dermal, rabbit) LC50 = 53000 mg/m3 (inhalation, mouse) | ||
| NIOSH (US health exposure limits): | |||
PEL (Permissible)
|
TWA 400 ppm (980 mg/m3)[3] | ||
| สารประกอบอื่นที่เกี่ยวข้องกัน | |||
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |||
ไอโซโพรพานอลผสมเข้ากับน้ำ อีเทอร์ และคลอโรฟอร์มได้ดี โดยเมื่อผสมกับน้ำแล้วจะเกิดเป็นสารกลั่นแยกไม่ได้ (azeotrope) สารนี้รับประทานไม่ได้ และมีจุดเยือกแข็งต่ำลง (คือ ช่วงอุณหภูมิที่เป็นของเหลวกว้างขึ้น)[4][5] นอกจากนี้ยังเป้นตัวทำละลายเอทิลเซลลูโลส โพลิไวนิลบิวทิรัล น้ำมัน อัลคาลอยด์ และยางไม้ได้[6] แต่ไม่ละลายในสารละลายเกลือ จึงทำให้สามารถแยกออกจากสารละลายได้โดยเติมเกลือแกง โซเดียมซัลเฟต หรือเกลืออนินทรีย์อย่างอื่นเพื่อให้แอลกอฮอล์แยกชั้นออกมา[4] ไอโซไพรพานอลมีสภาพดูดกลืน ที่ 205 mm ภายใต้สเปกตรัมรังสีอัลตราไวโอเลต[7][8]
ไอโซโพรพานอลผลิตได้โดยอาศัยปฏิกิริยาเติมน้ำเข้ากับโพรพีน จากกฎของมาร์คอฟนิคอฟซึ่งกล่าวว่า ไฮโดรเจนมีแนวโน้มจะผนวกเข้ากับคาร์บอนที่มีไฮโดรเจนมากกว่าเสมอ จึงทำให้เกิดไอโซโพรพานอล มากกว่าที่จะเป็น 1-โพรพานอล หรืออาจจะใช้ปฏิกิริยาของโพรพีนกับกรดซัลฟิวริก ให้ให้เกิดซัลเฟตเอสเทอร์ ที่เมื่อสลายด้วยน้ำแล้วจะได้ไอโซโฟรพิลแอลกอฮอล์ ในกระบวนการอย่างหลังจะมีไดไอโซโพรพิลอีเทอร์เป็นผลพลอยได้ ซึ่งสามารถนำกลับเข้าสู่กระบวนการอีกครั้ง นอกจากนี้ ไอโซโพรพานอลยังผลิดได้โดยเติมไฮโดรเจนลงในอะซีโทนก็ได้[9][10]
ไอโซโพรพานอลถูกนำไปใช้งานมากมาย อาทิ เป็นตัวทำละลายประสิทธิภาพสูงและมีพิษน้อยกว่าตัวทำละลายชนิดอื่น ใช้ทำความสะอาดคราบน้ำมัน อุปกรณ์อิเล็กทรอนิกส์[11] และใช้ผสมน้ำ 60 - 75% เพื่อฆ่าเชื้อโรค เช่น รอบบาดแผล หรือล้างมือ หากไม่ผสมน้ำ เยื้อหุ้มเซลล์ของแบคทีเรียจะไม่เปิดออกเพื่อให้แอลกอฮอล์ออกฤทธิ์ได้[12]
อ้างอิง
- ↑ Reeve, W.; Erikson, C.M.; Aluotto, P.F. (1979). "A new method for the determination of the relative acidities of alcohols in alcoholic solutions. The nucleophilicities and competitive reactivities of alkoxides and phenoxides". Can. J. Chem. 57 (20): 2747. doi:10.1139/v79-444.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 2.0 2.1 Yaws, C.L. (1999). Chemical Properties Handbook. McGraw-Hill. ISBN 0-07-073401-1.
- ↑ NIOSH Pocket Guide to Chemical Hazards. "#0359". National Institute for Occupational Safety and Health (NIOSH).
- ↑ 4.0 4.1 The Merck Index (10th ed.). Rahway, NJ: Merck & Co. 1983. p. 749.
- ↑ Logsden, John E.; Loke, Richard A (1999). "Propyl Alcohols". ใน Jacqueline I., Kroschwitz (บ.ก.). Kirk-Othmer Concise Encylclopedia of Chemical Technology, (4th ed.). New York: John Wiley & Sons, Inc. pp. 1654–1656. ISBN 978-0471419617.
- ↑ Doolittle, Arthur K. (1954). The Technology of Solvents and Plasticizers. New York: John Wiley & Sons, Inc. p. 628.
- ↑ "Isopropyl Alcohol, UltimAR, Suitable for Liquid Chromatography, Extract/Conc, UV-Spectrophotometry". VWR International. สืบค้นเมื่อ 25 August 2014.
- ↑ "UV Cutoff" (PDF). University of Toronto. สืบค้นเมื่อ 25 August 2014.
- ↑ Papa, A. J., "Propanols", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a22_173
- ↑ Logsdon, John E. and Loke, Richard A. (December 4, 2000). "Isopropyl Alcohol". Kirk‑Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc.
{{cite encyclopedia}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Market Study Solvents, Ceresana, published Apr 2012
- ↑ "Guide to Local Production: WHO-recommended Handrub Formulations" (PDF). World Health Organization. August 2009.