เซลล์ไฟฟ้าเคมี
บทความนี้ได้รับแจ้งให้ปรับปรุงหลายข้อ กรุณาช่วยปรับปรุงบทความ หรืออภิปรายปัญหาที่หน้าอภิปราย
|
เซลล์ไฟฟ้าเคมี (อังกฤษ: electrochemical cell) เป็นอุปกรณ์ที่สามารถผลิตพลังงานไฟฟ้าจากปฏิกิริยาเคมีหรือช่วยอำนวยความสะดวกในการทำให้เกิดปฏิกิริยาเคมีผ่านการการใช้พลังงานไฟฟ้า ตัวอย่างหนึ่งที่ใช้ร่วมกันของเซลล์ไฟฟ้าเคมีเป็นเซลล์มาตรฐาน 1.5 โวลต์ที่ผลิตขึ้นมาสำหรับการใช้งานของผู้บริโภค อุปกรณ์ชนิดนี้รู้จักกันว่าเป็นเซลล์กัลวานีเดี่ยว แบตเตอรี่จะประกอบด้วยเซลล์สองตัวหรือมากกว่าเชื่อมต่อกันแบบอนุกรมหรือแบบขนาน[1]
ประวัติเซลล์ไฟฟ้า
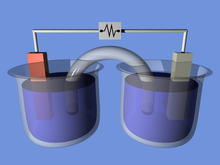
แก้เซลล์ไฟฟ้าเคมีประกอบด้วยสองครึ่งเซลล์ แต่ละครึ่งเซลล์ประกอบด้วยขั้วไฟฟ้าและอิเล็กโทรไลต์อย่างละหนึ่งตัว สองครึ่งเซลล์อาจใช้อิเล็กโทรไลต์เดียวกันหรือต่างกัน ปฏิกิริยาเคมีในเซลล์อาจเกี่ยวข้องกับทั้งอิเล็กโทรไลต์และขั้วไฟฟ้าและ/หรือกับสารภายนอก (เช่นในเซลล์เชื้อเพลิงที่อาจใช้แก๊สไฮโดรเจนเป็นตัวทำปฏิกิริยา) ในเซลล์ไฟฟ้าเคมีเต็มรูปแบบ สารละลายในหนึ่งครึ่งเซลล์จะสูญเสียอิเล็กตรอน (ออกซิเดชัน) ให้กับขั้วไฟฟ้าของมันในขณะที่สารละลายในอีกหนึ่งครึ่งเซลล์ได้อิเล็กตรอนเพิ่ม (รีดักชัน) จากขั้วไฟฟ้าของมัน
สะพานเกลือ (เช่นกระดาษกรองแช่อยู่ใน KNO3 หรืออิเล็กโทรไลต์อื่นบางอย่าง) มักถูกใช้เพื่อทำเป็นจัดติดต่อของไอออนระหว่างสองครึ่งเซลล์ที่มีอิเล็กโทรไลต์แตกต่างกัน อีกทั้งยังช่วยป้องกันสารละลายทั้งสองฝั่งไม่ให้ผสมกันและก่อให้เกิดปฏิกิริยาข้างเคียงที่ไม่พึงประสงค์ ทางเลือกนอกจากสะพานเกลือจะเป็นการยอมให้มีการติดต่อถึงกันโดยตรง (และผสมกัน) ระหว่างสองครึ่งเซลล์ เช่นในอิเล็กโทรไลต์ง่าย ๆ เป็นน้ำ
เมื่ออิเล็กตรอนไหลจากไปยังอีกครึ่งเซลล์หนึ่งผ่านวงจรภายนอก ความแตกต่างของประจุจะเกิดขึ้นทั้งสองฝั่ง หากไม่มีจุดติดต่อให้กับไอออน ความแตกต่างของประจุนี้จะป้องกันอย่างรวดเร็วไม่ให้อิเล็กตรอนไหลได้ต่อไป สะพานเกลือจะช่วยให้มีการไหลของประจุลบและประจุบวกเพื่อรักษาการกระจายในสถานะที่มั่นคงของประจุระหว่างอ่างออกซิเดชันและอ่างรีดักชัน ในขณะที่ยังคงแยกสารละลายออกจากกัน อุปกรณ์อื่น ๆ เพื่อทำการแยกสารละลายออกจากกันได้แก่หม้อที่มีรูพรุนและสารละลายที่เป็นเจล หม้อที่มีรูพรุนถุกใช้ในเซลล์บันเซน (ขวา)
ปฏิกิริยาสมดุล
แก้แต่ละครึ่งเซลล์มีแรงดันไฟฟ้าลักษณะเฉพาะ (อังกฤษ: characteristic voltage) สสารที่เป็นทางเลือกสำหรับแต่ละครึ่งเซลล์มีหลากหลาย พวกมันจะให้ความต่างศักย์ที่แตกต่างกัน แต่ละปฏิกิริยาจะดำเนินการเพื่อการสมดุลทางเคมีระหว่างสถานะออกซิเดชันที่แตกต่างกันของไอออน: เมื่อเกิดความสมดุล เซลล์จะไม่สามารถให้แรงดันไฟฟ้าสูงสุดอีกต่อไป ในครึ่งเซลล์ที่กำลังเกิดออกซิเดชัน ยิ่งความสมดุลเข้าใกล้กับไอออน/อะตอมที่มีสถานะออกซิเดชันในเชิงบวกมากเท่าไร ศักย์ไฟฟ้าที่ปฏิกิริยานี้จะสร้างให้ก็ยิ่งมากขึ้นเท่านั้น ในทำนองเดียวกันในปฏิกิริยารีดักชัน ยิ่งความสมดุลเข้าใกล้กับไอออน/อะตอมที่มีสถานะออกซิเดชันในเชิงลบมากเท่าไร ศักย์ไฟฟ้าที่ปฏิกิริยานี้จะสร้างให้ก็ยิ่งมากขึ้นเท่านั้น
ศักย์ของเซลล์
แก้ศักย์ของเซลล์สามารถทำนายได้โดยการใช้ศักย์ของขั้วไฟฟ้า (แรงดันไฟฟ้าของแต่ละครึ่งเซลล์) ศักย์ของครึ่งเซลล์เหล่านี้จะถูกกำหนดเทียบกับแรงดัน 0 โวลต์ที่มอบหมายให้กับขั้วไฟฟ้าไฮโดรเจนมาตรฐาน (อังกฤษ: standard hydrogen electrode (SHE)) (ดูตารางที่ศักย์มาตรฐานของขั้วไฟฟ้า) ความแตกต่างในแรงดันไฟฟ้าระหว่างศักย์ขั้วไฟฟ้าทั้งสองจะสามารถคาดการณ์ถึงศักย์ที่จะทำการวัด เมื่อคำนวณค่าความแตกต่างของแรงดันไฟฟ้า เราต้องเขียนสมการปฏิกิริยาครึ่งเซลล์ขี้นใหม่ก่อนเพื่อหาสมการอ๊อกซิเดชัน-รีดักชันที่สมดุล
- ย้อนกลับปฏิกิริยารีดักชันด้วยศักย์ขนาดเล็กที่สุด (เพื่อสร้างปฏิกิริยาออกซิเดชัน/ศักย์เซลล์บวกโดยรวม)
- ปฏิกิริยาครึ่งจะต้องคูณด้วยจำนวนเต็มเพื่อให้อิเล็กตรอนเกิดความสมดุล
ข้อสังเกต ศักย์ของเซลล์จะไม่เปลี่ยนแปลงเมื่อปฏิกิริยาจะถูกคูณด้วยค่าคงที่
ศักย์ของเซลล์สามารถมีช่วงประมาณศูนย์ถึง 6 โวลต์ เซลล์ที่ใช้อิเล็กโทรไลต์ที่ผสมน้ำมักจะจำกัดศักย์ของเซลล์ไว้ที่น้อยกว่าประมาณ 2.5 โวลต์ เพราะส่วนผสมสำคัญเพื่อทำออกซิเดชันและรีดักชันที่มีประสิทธิภาพมากในการผลิตศักย์เซลล์ที่สูงขึ้นจะมีแนวโน้มที่จะทำปฏิกิริยากับน้ำ ศักย์ของเซลล์ที่สูงขึ้นมีความเป็นไปได้กับเซลล์ที่ใช้ตัวทำละลายอื่นแทนน้ำ ยกตัวอย่างเช่นเซลล์ลิเธียมที่มีแรงดันไฟฟ้า 3 โวลต์ที่มีอยู่ทั่วไป
ศักย์ของเซลล์ขึ้นอยู่กับความเข้มข้นของสารทำปฏิกิริยาและชนิดของพวกมัน เมื่อเซลล์กำลังถูกใช้งาน ความเข้มข้นของสารทำปฏิกิริยาก็ลดลงและศักย์ของเซลล์ก็ลดลงด้วย