ไฮดรอกไซด์
ไฮดรอกไซด์ไอออน เป็นไอออนประจุลบอะตอมคู่ มีสูตรเคมีเป็น OH− ประกอบด้วยอะตอมออกซิเจนและไฮโดรเจนยึดเข้าด้วยกันโดยพันธะโควาเลนต์ และมีประจุไฟฟ้าลบ เป็นองค์ประกอบตามธรรมชาติของน้ำ มีสมบัติเป็นเบสต่อกรด หรือเป็นลิแกนด์ต่อโลหะ โดยเสียอิเล็กตรอนหนึ่งถึงสามคู่ให้แก่โลหะศูนย์กลาง ไฮดรอกไซด์ไอออนสามารเกิดเป็นสารประกอบไฮดรอกไซด์กับธาตุหมู่ 1 และหมู่ 2 ได้เป็นสารประกอบของแข็ง ไฮดรอกไซด์เหล่านี้จะแตกตัวในสารละลายในน้ำ และได้เป็นไฮดรอกไซด์ไอออน โซเดียมไฮดรอกไซด์เป็นเคมีโภคภัณฑ์ที่มีการบริโภคนับหลายล้านตันต่อปี กลุ่มไฮดรอกไซด์เมื่อร่วมเข้ากับธาตุกลางที่มีอิเล็กโตรเนกาทิวิตีสูงอาจทำให้ตัวมันเองแตกตัว ได้เป็นไฮดรอกไซด์ไอออน ทำให้เกิดเป็นสารต้นแบบของกรด
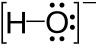
ในเคมีอินทรีย์ ไฮดรอกไซด์ไอออนสามารถมีสมบัติเป็นคะตะลิสต์หรือเป็นตัวทำปฏิกิริยานิวคลีโอไฟล์ กลุ่ม OH หรือที่รู้จักกันในชื่อกลุ่มไฮดรอกซิล ปรากฏในแอลกอฮอล์ กรดฟีนอลคาร์บอกซิลิก และสารประกอบอินทรีย์ที่เกี่ยวข้อง
ลักษณะ แก้
ไฮดรอกไซด์ไอออนเป็นองค์ประกอบตามธรรมชาติของน้ำ เนื่องจากปฏิกิริยาการแตกตัวของน้ำ:[1]
- H+ + OH– ⇌ H2O
ค่าคงที่สมดุลของปฏิกิริยานี้ สามารถหาได้จาก
- Kw = [H+][OH–]
ซึ่งมีค่าใกล้เคียงกับ 10−14 ที่อุณหภูมิ 25 °C ดังนั้น ความเข้มข้นของไฮดรอกไซด์ไอออนในน้ำบริสุทธิ์จึงอยู่ใกล้เคียงกับ 10−7 โมลต่อลูกบาศก์เดซิเมตร (mol dm−3) เพื่อที่จะให้เป็นไปตามข้อจำกัดประจุเท่ากัน ค่า pH ของสารละลายเท่ากับลอการิทึมร่วมเกี่ยวทศนิยมของความเข้มข้นของไฮโดรเจนไอออน pH ของน้ำบริสุทธิ์มีค่าใกล้เคียงกับ 7 ที่อุณหภูมิห้อง ความเข้มข้นของไฮดรอกไซด์ไอออนสามารถแสดงให้อยู่ในรูป pOH ซึ่งมีค่าใกล้เคียงกับ 14 − pH ดังนั้น ค่า pOH ของน้ำบริสุทธิ์จึงมีค่าใกล้เคียงกับ 7 เช่นกัน การเพิ่มเบสลงไปในน้ำจะเป็นการลดความเข้มข้นของไฮโดรเจนไอออนและเพิ่มความเข้มข้นของไฮดรอกไซด์ (กล่าวคือ เพิ่มค่า pH และลดค่า pOH) ถึงแม้ว่าในเบสที่เติมลงไปนั้นจะไม่มีไฮดรอกไซด์เป็นส่วนประกอบอยู่เลยก็ตาม ยกตัวอย่างเช่น สารประกอบแอมโมเนียมีค่า pH มากกว่า 7 เนื่องจากปฏิกิริยา NH3 + H+ ⇌ NH4+ ซึ่งส่งผลทำให้ความเข้มข้นของไฮโดรเจนไอออนลดลง และความเข้มข้นของไฮดรอกไซด์ไอออนเพิ่มขึ้น pOH สามารถถูกรักษาไว้ที่ใกล้เคียงกับค่าคงด้วยสารละลายบัฟเฟอร์หลายชนิด
ในสารละลายในน้ำ[2] ไฮดรอกไซด์ไอออนถือว่าเป็นเบส ตามทฤษฎีของเบรินสเตด-ลาวรี เนื่องจากมันสามารถรับโปรตอนจากกรดตามทฤษฎีของเบรินสเตด-ลาวรีเพื่อสร้างเป็นโมเลกุลน้ำได้ นอกจากนี้ มันยังมีสมบัติเป็นเบสลิวอิสโดยการเสียอิเล็กตรอนให้แก่กรดลิวอิส ในสารละลายในน้ำ ทั้งไฮโดรเจนไอออนและไฮดรอกไซด์ต่างก็เป็นตัวทำละลายแก่ทั้งคู่ โดยพันธะไฮโดรเจนระหว่างอะตอมออกซิเจนและไฮโดรเจน ไอออนไบไฮดรอกไซด์ H3O2− มีลักษณะพิเศษเป็นของแข็ง สารประกอบดังกล่าวเป็นสมมาตรศูนย์กลางและมีพันธะไฮโดรเจนที่สั้นมาก (114.5 พิโคเมตร) ซึ่งใกล้เคียงกับความยาวของพันธะในไอออนไบฟลูออไรด์ HF<หรั่งb>2− (114 พิโคเมตร)[3] ในสารละลายไฮดรอกไซด์สร้างพันธะไฮโดรเจนที่แข็งแรงกับโมเลกุลน้ำ ผลที่เกิดขึ้นตามมาคือ สารละลายโซเดียมไฮดรอกไซด์เข้มข้นจะมีความหนืดสูงเนื่องจากการก่อตัวของเครือข่ายขยายของพันธะไฮโดรเจนเช่นเดียวกับในสารละลายไฮโดรเจนฟลูออไรด์
ในสารละลาย ไฮดรอกไซด์ไอออนทำปฏิกิริยาอย่างรวดเร็วกับคาร์บอนไดออกไซด์ในบรรยากาศ ซึ่งมีสมบัติคล้ายกับกรด เพื่อสร้างไอออนไบคาร์บอเนต
- OH– + CO2 ⇌ HCO3–
ค่าคงที่สมดุลสำหรับปฏิกิริยานี้สามารถกำหนดได้เป็นปฏิกิริยากับคาร์บอนไดออกไซด์แตกตัว หรือเป็นปฏิกิริยากับแก๊สคาร์บอนไดออกไซด์ ที่สภาวะเป็นกลางหรือกรด ปฏิกิริยาจะเกิดขึ้นได้ช้า แต่สามารถแรงปฏิกิริยาได้โดยเอนไซม์คาร์บอร์นิคแอนไฮเดรส ซึ่งสามารถสร้างไฮดรอกไซด์ไอออนได้อย่างรวดเร็วที่บริเวณเร่ง
สารละลายที่ประกอบด้วยไฮดรอกไซด์จะทำอันตรายต่อแก้ว ในกรณีนี้ ซิลิเกตในแก้วจะมีสมบัติเสมือนกรด ส่วนไฮดรอกไซด์ซึ่งมีสมบัติเป็นเบส ไม่ว่าจะอยู่ในสถานะของแข็งหรืออยู่ในสารละลายก็ตาม จะถูกเก็บไว้ในภาชนะพลาสติกที่ปิดมิดชิดไม่ให้อากาศเข้าไปได้
ไฮดรอกไซด์ไอออนสามารถทำหน้าที่เป็นลิแกนต์ตัวให้อิเล็กตรอน ซึ่งสามารถสร้างเป็นสารประกอบเชิงซ้อนได้เป็น [Al(OH)4]– นอกจากนี้ ยังมักถูกพบในสารประกอบเชิงซ้อนลิแกนต์ผสม ประเภท [MLx(OH)y]z+ โดยที่ L คือลิแกนต์ ไฮดรอกไซด์ไอออนมักจะทำหน้าที่เสมือนเป็นลิแกนต์ตัวเชื่อม โดยให้อิเล็กตรอนหนึ่งคู่ให้แก่แต่ละอะตอมที่ถูกเชื่อม ดังที่ปรากฏใน [Pb2(OH)]3+ ไฮดรอกไซด์โลหะมักจะเขียนในรูปอย่างง่าย มันยังสามารถมีสมบัติเป็นตัวให้อิเล็กตรอนสามคู่ ดังที่ปรากฏในเตตระเมอร์ [PtMe3OH]4[4]
เมื่อสร้างพันธะกับศูนย์กลางโลหะที่เป็นตัวให้อิเล็กตรอนอย่างแรงแล้ว ลิแกนต์ไฮดรอกไซด์มักจะแตกตัวเป็นลิแกนต์ออกไซด์ ยกตัวอย่างเช่น ไอออนไบโครเมท ซึ่งสามารถเขียนเป็นสูตรได้ [HCrO4]– จะแตกตัวดังสมการ
- [O3CrO-H]– ⇌ [CrO4]2– + H+
โดยที่ pKa มีค่าประมาณ 5.9[5]
อ้างอิง แก้
- ↑ Geissler P. L.; Dellago C.; Chandler D.; Hutter J.; Parrinello M. (2001). "Autoionization in liquid water". Science. 291: 2121–2124. doi:10.1126/science.1056991.
- ↑ Marx, D.; Chandra A; Tuckerman M.E. (2010). "Aqueous Basic Solutions: Hydroxide Solvation, Structural Diffusion, and Comparison to the Hydrated Proton". Chem. Rev. 110 (4): 2174–2216. doi:10.1021/cr900233f.
- ↑ Kamal Abu-Dari; Kenneth N. Raymond; Derek P. Freyberg (1979). "The bihydroxide (H3O2−) anion. A very short, symmetric hydrogen bond". J. Am. Chem. Soc. 101: 3688–3689. doi:10.1021/ja00507a059.
- ↑ Greenwood, p 1168
- ↑ IUPAC SC-Database เก็บถาวร 2017-06-19 ที่ เวย์แบ็กแมชชีน A comprehensive database of published data on equilibrium constants of metal complexes and ligands